 第37讲 弱电解质的电离平衡
第37讲 弱电解质的电离平衡【复习目标】
1.理解弱电解质在水溶液中的电离平衡。
2.理解电离平衡常数,掌握电离平衡常数的相关计算。
3.能举例说明离子反应与平衡在生产、生活中的应用。
【知识精讲】
考点一 弱电解质的电离平衡及影响因素
1.强、弱电解质
(1)强电解质:在水溶液或熔融状态下能全部电离的电解质。包括以下几种:
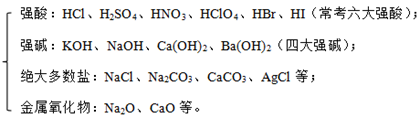
(2)弱电解质:在水溶液或熔融状态下部分电离的电解质。包括以下几种:
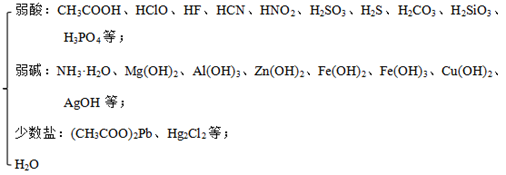
(3)电离方程式的书写
①强电解质:“强等号”,如H2SO4的电离方程式为H2SO4===2H++SO2-4。
②弱电解质:“弱可逆”
a.一元弱酸,如CH3COOH的电离方程式为CH3COOH CH3COO-+H+。
b.一元弱碱,如NH3·H2O的电离方程式为NH3·H2O NH+4+OH-。
c.多元弱酸,分步电离,分步书写,如H2CO3的电离方程式为
H2CO3 H++HCO-3、HCO-3 H++CO2-3。
d.多元弱碱,分步电离,一步书写,如Fe(OH)3的电离方程式为Fe(OH)3 Fe3++3OH-。
e.两性物质双向电离,如Al(OH)3的电离方程式为
H++A
资料标签: