
本套打包资料共含100份word文档,通过打包的方式更加方便下载。

2.命题规律及备考策略
【命题规律】
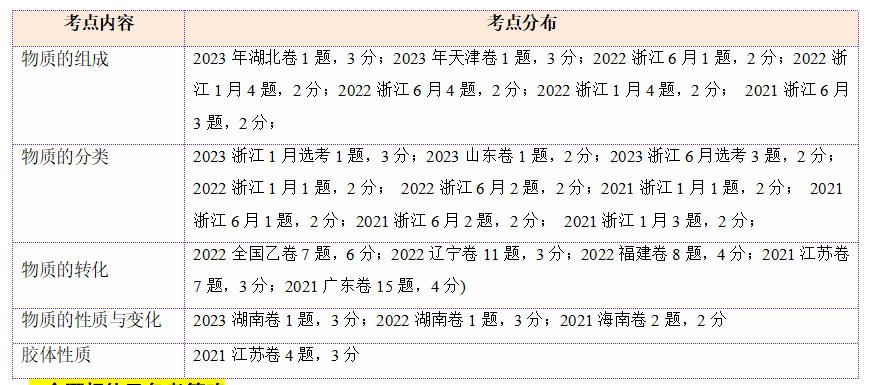
高频考点从近几年全国高考试题来看,物质的组成、分类及物质的转化、胶体的性质及其应用、丁达尔效应仍是高考命题的热点。
【备考策略】
解答有关物质的分类及转化试题的方法步骤
第一步——读题:挖掘关键字,排除干扰信息,找出有效信息。
第二步——联题:结合题目中的问题或选项分析本题考查的知识板块,联系中学化学知识体系,寻找要提取的信息。
第三步——析题:找到需要的信息后,需进行分析、加工、整合。
第四步——解题:注意根据题目的要求正确切入,分析筛选相应问题。
【命题预测】
预计2025年高考会以新的情境载体考查有关物质的成分、分类、转化、胶体的本质知识,题目难度一般较小。
考法01 物质的组成与分类
1.物质的组成
(1)元素
元素是具有相同核电荷数的一类原子的总称。元素在自然界的存在形式有游离态和化合态。
①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
(2)元素组成物质
元素组成(――→)化合物:不同种元素组成的纯净物(单质:同种元素组成的纯净物)
(3)纯净物与混合物
①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
【易错提醒】
纯净物和混合物判断中的特殊情况
①只含一种元素的物质不一定是纯净物,也可能是混合物,如O2和O3,金刚石和石墨,红磷和白磷。
②结晶水合物属于纯净物,如CuSO4·5H2O、KAl(SO4)2·12H2O等物质。
③由同位素的不同原子形成的单质或化合物是纯净物,如H2与D2、H2O和D2O。
④分子式为C5H10的物质可能是纯净物,也可能是混合物。
⑤有机高分子属于混合物,如聚乙烯、淀粉等。
(4)同素异形体
①定义:由同一种元素形成的几种性质不同的单质。
②性质:物理性质不同,化学性质有差异。同素异形体之间在一定条件下可以相互转化,这种转化是化学变化。
③常见元素的同素异形体
氧元素:O2和O3;碳元素:金刚石、石墨、C60;磷元素:白磷、红磷。
(5)氧化物的类型
①酸性氧化物:与碱反应生成相应的盐和水的氧化物,如SO2、CO2、SO3、N2O5、P2O5等。
②碱性氧化物:与酸反应生成相应的盐和水的氧化物,如Na2O、CaO、CuO、Fe2O3、FeO等。
③两性氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3。
④不成盐氧化物:如CO、NO等。
⑤特殊氧化物:如Na2O2等。
【易错提醒】
酸性氧化物不一定是非金属氧化物,如:Mn2O7;非金属氧化物也不一定是酸性氧化物,如:CO、NO等;金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物。