
下列有关化学反应速率的说法中,正确的是
A.汽车尾气中的NO和CO反应生成N2和CO2的速率很小,使用催化剂可提高化学反应的速率
B.等质量的锌粉和锌片与相同体积、相同物质的量浓度的盐酸反应,反应速率相等
C.某反应是一个放热反应,所以升高温度,逆反应速率增大,正反应速率减小
D.用铁片与硫酸反应制取氢气时,用质量分数为98%的浓硫酸可以提高产生氢气的速率
【答案】A
【详解】A.汽车尾气中的NO和CO反应生成N2和CO2的速率很小,使用催化剂可降低反应的活化能,从而提高化学反应的速率,故A正确;
B.等质量的锌粉和锌片与相同体积、相同物质的量浓度的盐酸反应,锌粉的接触面积较大,锌粉与盐酸的反应速率较快,故B错误;
C.无论是吸热反应还是放热反应,升高温度,正逆反应速率均增大,故C错误;
D.铁片在质量分数为98%的浓硫酸中发生钝化现象,无法获得氢气,故D错误;
故选:A。
2.反应 的两种反应过程中的能量变化曲线如图a、b所示,下列说法错误的是
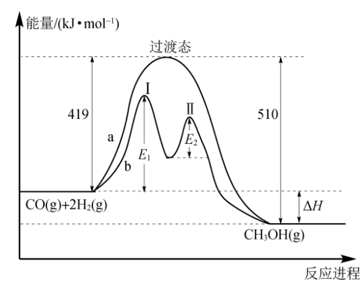
A.a过程中正反应的活化能为
B.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
C.b过程使用催化剂后降低了反应的活化能
D.b过程的反应速率:第Ⅰ阶段>第Ⅱ阶段
【答案】D
【详解】A.根据图像可知,a过程中正反应的活化能为 ,A正确;
B.b过程中第Ⅰ阶段反应物总能量低于生成物总能量,为吸热反应,第Ⅱ阶段反应物总能量高于生成物总能量,为放热反应,B正确;
C.根据图像可知,b过程使用催化剂后降低了反应的活化能,C正确;
D.b过程中第二阶段活化能低,所以反应速率:第Ⅱ阶段>第Ⅰ阶段,D错误;
故选:D。