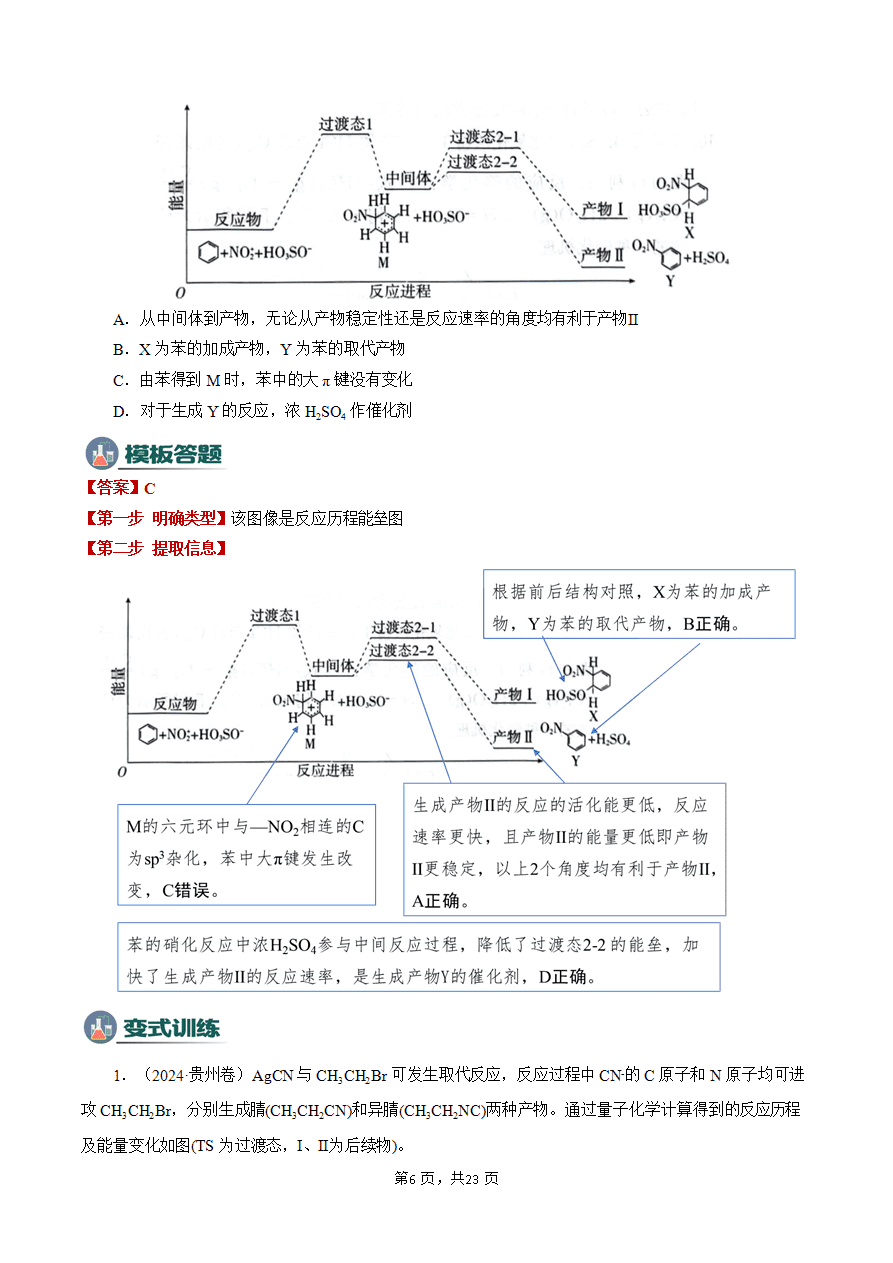
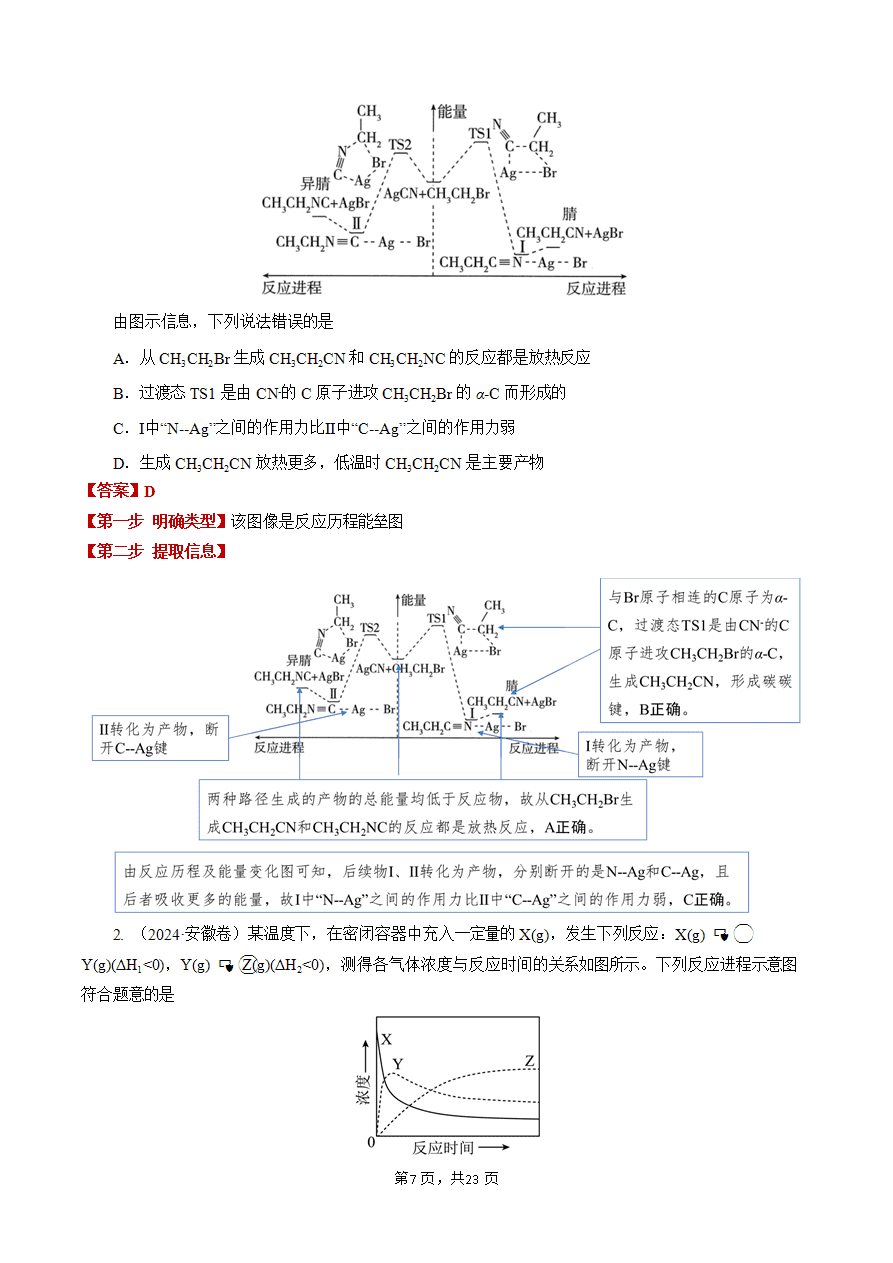
基元反应和过渡态理论
1.基元反应
(1)大多数的化学反应往往经过多个反应步骤才能实现,其中每一步反应都称为基元反应。
(2)基元反应速率方程
对于基元反应aA+bB===gG+hH,其速率方程可写为v=k·ca(A)·cb(B)(其中k称为速率常数,恒温下,k不因反应物浓度的改变而变化),这种关系可以表述为基元反应的化学反应速率与反应物浓度以其化学计量数为指数的幂的乘积成正比。
2.反应机理
基元反应构成的反应序列称为反应历程(又称反应机理),基元反应的总和称为总反应。由几个基元反应组成的总反应也称复杂反应。
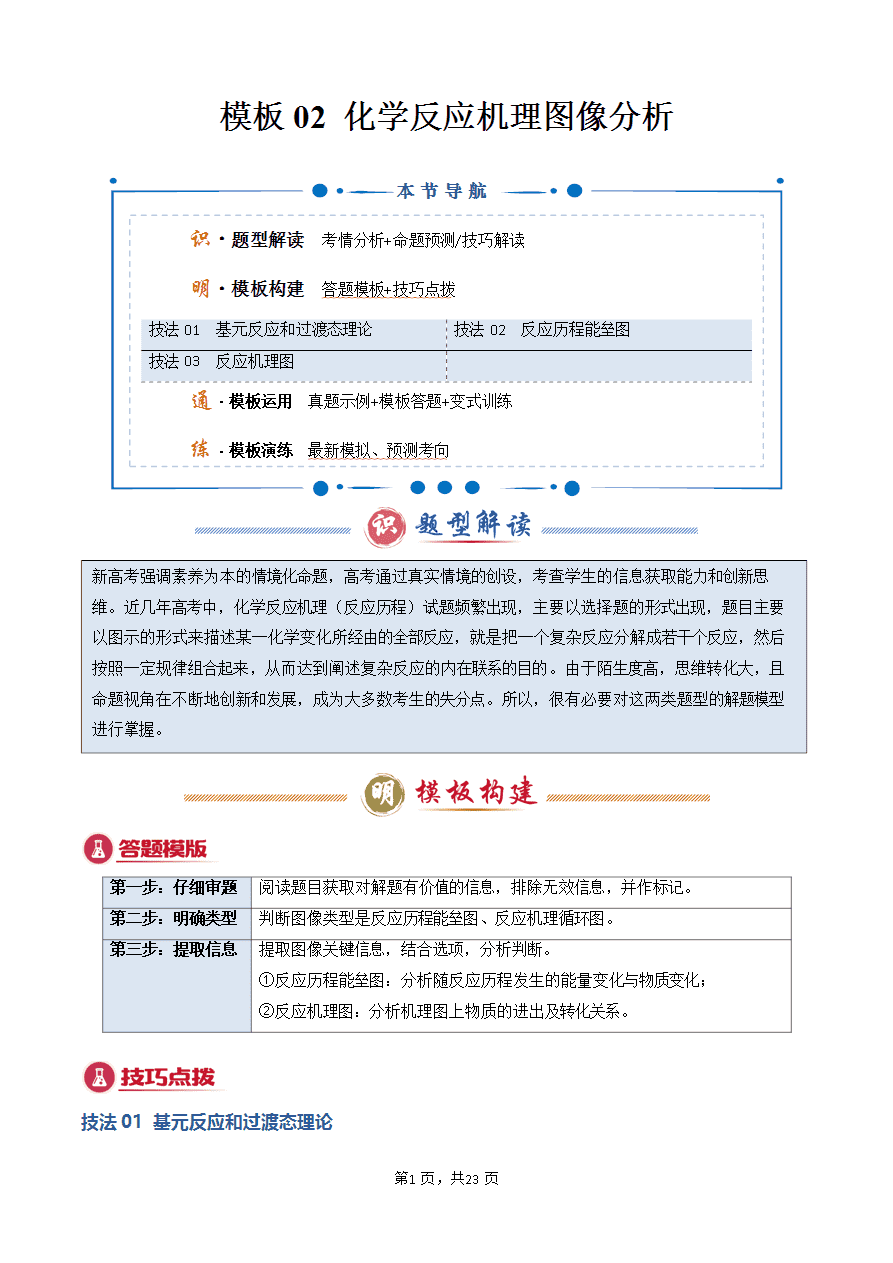
例如H2(g)+I2(g)===2HI(g),它的反应历程有如下两步基元反应:
①I2I·+I·(快)
②H2+2I·===2HI(慢)
其中慢反应为整个反应的决速步骤。
3.过渡态理论
(1)化学反应并不是通过反应物分子的简单碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能的过渡态,处于过渡态的分子叫做活化络合物。活化络合物是一种高能量的不稳定的反应物原子组合体,它能较快地分解为新的能量较低的较稳定的生成物。
(2)活化能(Ea)是处在过渡态的活化络合物分子平均能量与反应物分子平均能量的差值。
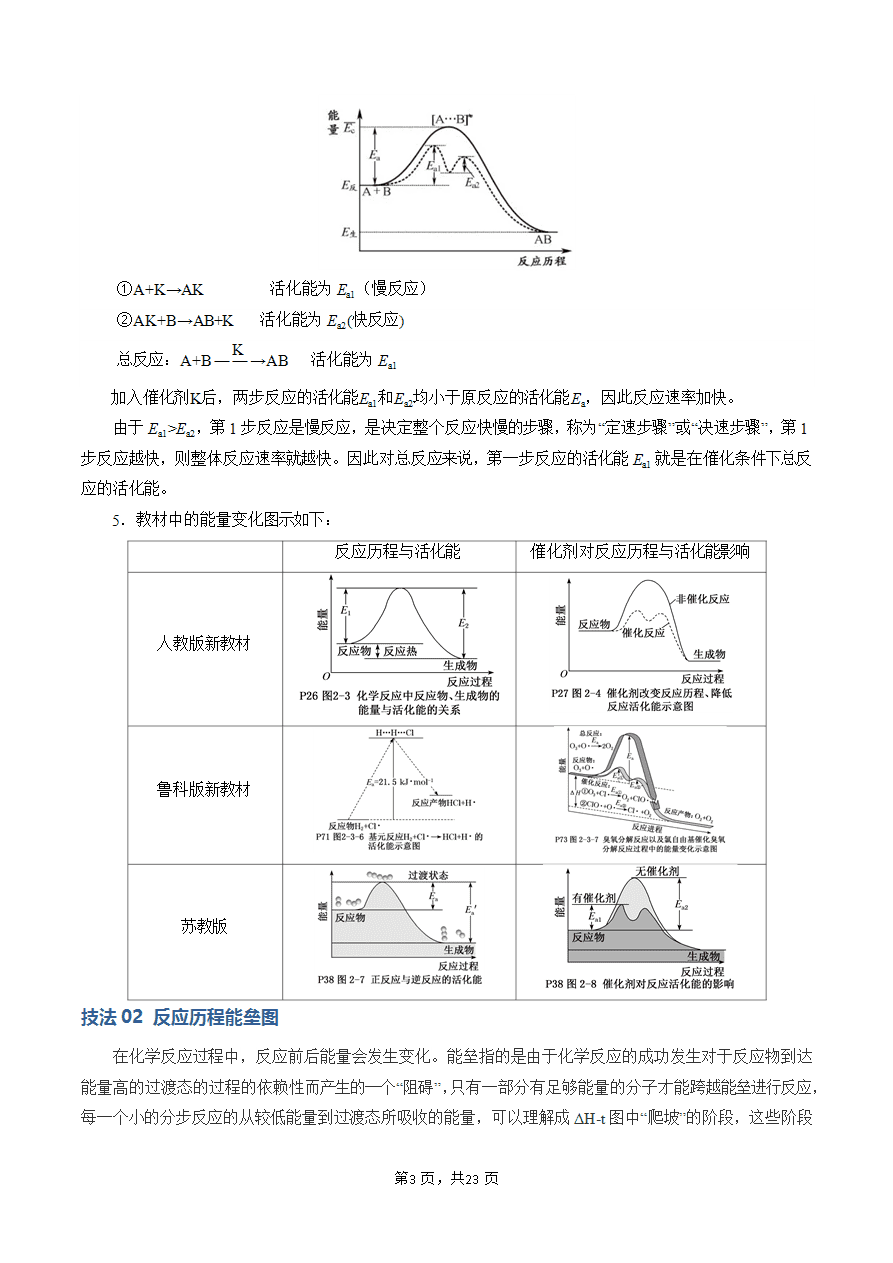
4.催化剂与反应历程
(1)催化剂对反应速率的影响
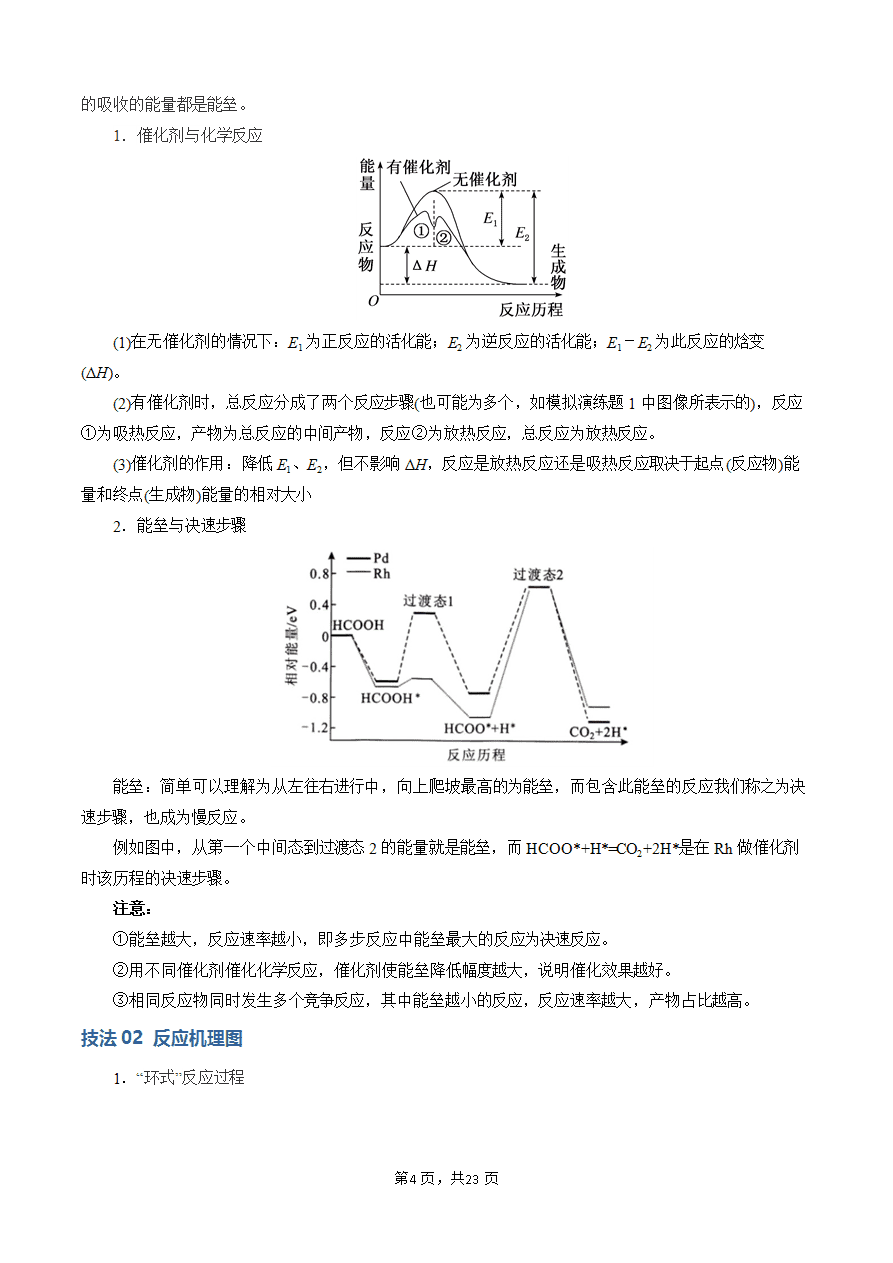
催化剂是通过降低化学反应所需的活化能来增大化学反应速率的。有催化剂参与的反应,活化能(Ea1)较小,反应速率较大;没有催化剂参与的反应,活化能(Ea1')较大,反应速率较小。
使用催化剂同时降低了正反应和逆反应的活化能,但反应的ΔH不变。