
反应热及其表示方法
1.两个角度认识反应热
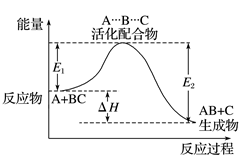
(1)从微观的角度说,是旧化学键断裂吸收的能量与新化学键形成放出的能量的差值。
在图中,E1表示旧化学键断裂吸收的能量;E2表示新化学键形成放出的能量;∆H表示反应热。
(2)从宏观的角度说,是反应物总能量与生成物总能量的差值。
在图中,E1表示活化能;E2表示活化分子变成生成物分子所释放的能量;∆H表示反应热。
2.反应热的表示方法——热化学方程式
热化学方程式书写或判断的注意事项:
(1)注意ΔH的符号和单位:吸热反应的ΔH为“+”,放热反应的ΔH为“-”;ΔH的单位为kJ·mol-1。
(2)注意测定条件:绝大多数的反应热是在25 ℃、101 kPa下测定的,此时可不注明温度和压强。
资料标签: