





题组一 硫酸的性质及工业制法
1.(2024·广东韶关高一下段考)下列事实与括号中浓硫酸的性质对应关系正确的是( )
A.用浓硫酸在纸上书写的字迹变黑(氧化性)
B.浓硫酸可用来干燥某些气体(吸水性)
C.空气中敞口久置的浓硫酸质量增大(挥发性)
D.浓硫酸在加热条件下与铜反应(脱水性)
2.(2024·石家庄高一段考)工业上制硫酸涉及的三个装置如图,下列有关说法错误的是( )
A.沸腾炉的进料口a加黄铁矿,进料口b通空气,发生反应的化学方程式3FeS2+8O2Fe3O4+6SO2
B.接触室中的反应主要为2SO2+O22SO3
C.吸收塔中不用水吸收SO3的原因是SO3溶于水时放出大量的热,从而形成酸雾,降低吸收效率
D.常温下,铁粒与足量浓硫酸混合会发生化学反应,但最终铁粒仍有剩余
3.(2024·河北沧州高一段考)加热时,浓硫酸能与木炭发生反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O。下列说法正确的是( )
A.该反应中浓硫酸体现了强氧化性和酸性
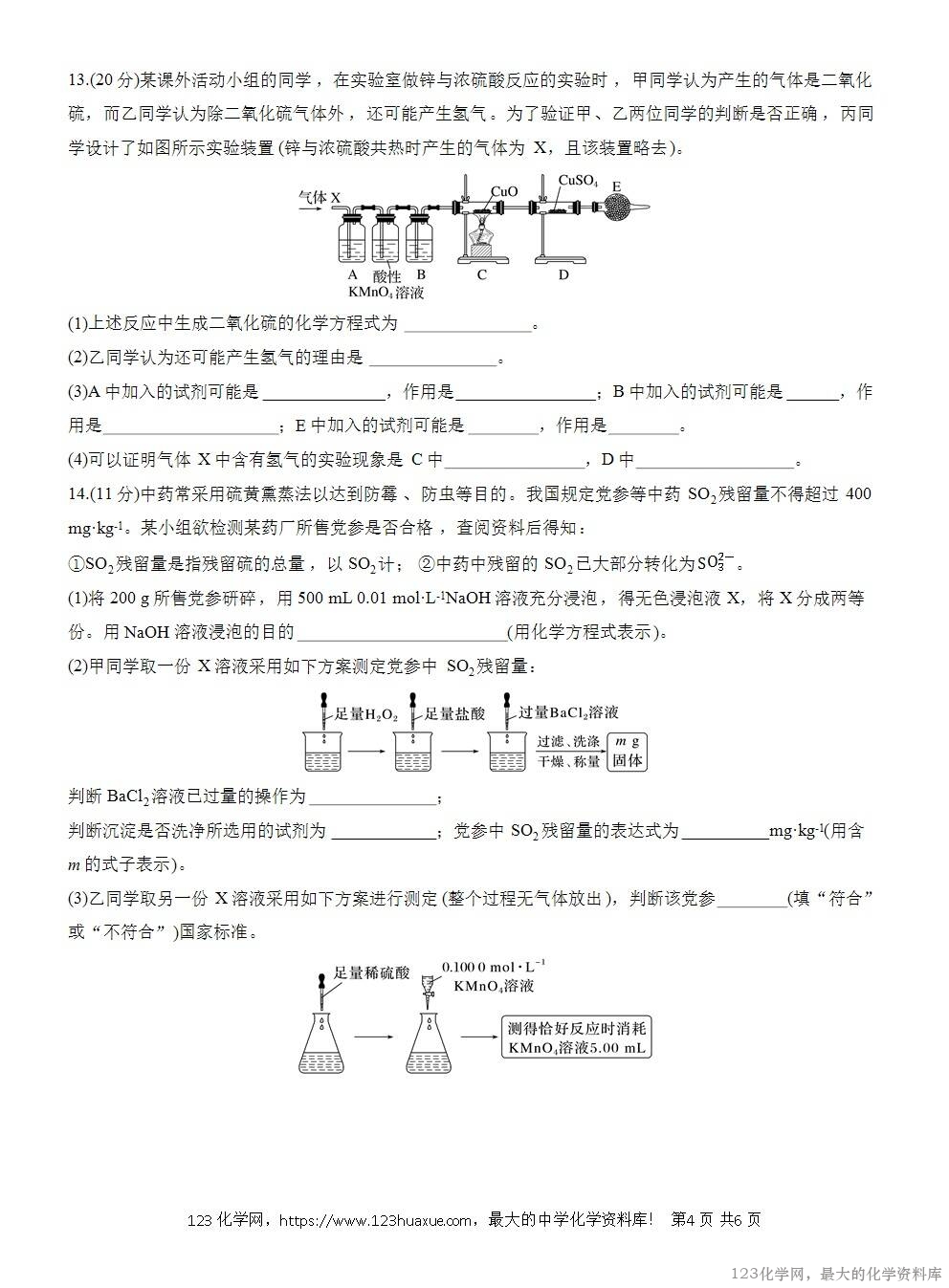
B.可以用澄清石灰水鉴别CO2和 SO2
C.含2 mol H2SO4的浓硫酸和足量的炭反应一定生成67.2 L(标准状况)气体
D.将生成的气体通入Ba(NO3)2溶液会产生白色沉淀
4.浓硫酸与下列物质作用时,既表现氧化性,又表现酸性的是( )
①炽热的木炭 ②H2S气体 ③Cu(加热条件下) ④FeO ⑤NH3 ⑥蔗糖 ⑦CuSO4·5H2O ⑧铁、铝(常温下)
A.③④ B.①②⑤⑧
C.①②③④⑦ D.⑥⑦
5.5 mL物质的量浓度为18 mol·L-1的硫酸中加入足量铜片并加热,充分反应。下列说法正确的是( )
A.有0.09 mol的硫酸被还原
B.有0.045 mol的硫酸被还原
C.充分反应后体系无硫酸剩余
D.消耗的铜的质量一定小于2.88 g
题组二 硫酸根离子的检验
6.下列检验试样中有无S的操作及结论正确的是( )
A.滴加BaCl2溶液,有白色沉淀生成,一定有S
B.滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,一定有S
C.滴加硝酸酸化的AgNO3溶液,没有白色沉淀生成,一定没有S
D.先加盐酸无明显现象,再加BaCl2溶液,有白色沉淀生成,一定有S
7.有一瓶Na2SO3溶液,它可能部分被氧化。某同学取该少量溶液,滴入BaCl2溶液,产生白色沉淀,再加入足量稀硫酸,充分振荡后仍有白色沉淀。对此实验,下述结论正确的是( )
A.亚硫酸钠已部分被空气中的氧气氧化
B.加入BaCl2溶液后,生成的沉淀中不一定含有BaSO4
C.加入稀硫酸后,不溶沉淀可能是BaSO3
D.此实验能确定亚硫酸钠是否被部分氧化