
第二节 化学反应的速率与限度
第一课时 化学反应的速率
【学习目标】1.通过阅读思考,联系化工生产、生活实际,了解化学反应的快慢的含义及化学反应的快慢对生活、生产的关系。
2.通过归纳小结,理解和掌握化学反应速率的概念及表示方法,并能运用表达式进行反应速率的简单计算及大小比较。
3.通过实验探究,能从微观角度理解外界条件(浓度、压强等)对化学反应速率的影响,学会“变量控制”的科学方法,增强证据推理意识,培养学生科学探究的能力。
【学习重点】化学反应速率的概念及影响化学反应速率的因素
【学习难点】应用控制变量法理解影响化学反应速率的因素
【课前预习】
旧知回顾:1.化学反应需要加热,该反应是否是吸热反应?放热反应一定容易发生,吸热反应一定不易发生吗?
【答案要点】①都不一定;原因是化学反应放热还是吸热取决于反应物和生成物具有总能量的相对大小,与反应是否加热无关。
②不一定。反应放热和吸热与反应条件无关,有些放热反应必须加热才能发生,如木炭的燃烧;而有些吸热反应在常温下就能发生,如Ba(OH)2·8H2O与NH4Cl的反应。
2.原电池是加快氧化还原反应的速率的原理是什么?请举例说明有哪些应用?
【答案要点】①原理:在原电池中,氧化反应和还原反应分别在两极进行,使溶液中粒子运动相互间的干扰减小,使反应速率增大。
②应用:实验室用Zn和稀H2SO4(或稀盐酸)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌、稀H2SO4形成原电池,加快了锌的腐蚀,使产生H2的速率加快。
新知预习:1.化学反应速率的概念及表达式式什么?有何特点?
【答案要点】①化学反应速率的定义是单位时间内反应物的浓度减少或生成物浓度的增加来表示。
表达式:v(A)=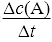 ,单位:mol/L·s 或 mol/L·min。
,单位:mol/L·s 或 mol/L·min。
②同一反应各物质的反应速率的关系是同一反应各物质的反应速率之比等于化学计量数之比。
2.影响化学反应速率的主要因素是什么?
【答案要点】影响化学反应速率的决定因素是物质本身的性质,影响化学反应速率的外界因素除温度和催化剂外,还有溶液的浓度、反应物的状态、固体的表面积、压强、溶剂、光照等许多因素,人们可以通过这些因素来调控化学反应速率。
【课中探究】
情景导入:有些化学反应如煤炭窑内的瓦斯爆炸,反应迅速,破坏力强。而溶洞中的石笋、石油等则需要数十万年,甚至百万年才能形成,可见化学反应也有快慢之分。(图片见PPT)
一、化学反应速率
活动一、化学反应速率及其表示方法
任务一、观察思考:观察教材P42图6-15,结合“思考与交流”,思考定性观察和研究某些化学反应快慢的方法是什么?在化学上如何定量地判断一个化学反应的快慢的呢?
【答案要点】①可以通过观察实验现象如:产生气泡、出现浑浊、颜色变化等宽慢判断反应速率的快慢。
②在科学研究和实际应用中,往往需要定量地描述一个反应的快慢。化学上通常用单位时间内反应物浓度的减小量或生成物浓度的增加量来表示化学反应的快慢。
任务二、讨论交流:阅读教材P42-43页内容,回答化学反应速率的定义、表达式、意义分别是什么?
【答案要点】①定义:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。