
2025~2026高中化学选择性必修1教案学案06第二章第一节第2课时影响化学反应速率的因素活化能









1.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响。
2.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。
3.能用一定的理论模型说明外界条件改变对化学反应速率的影响。
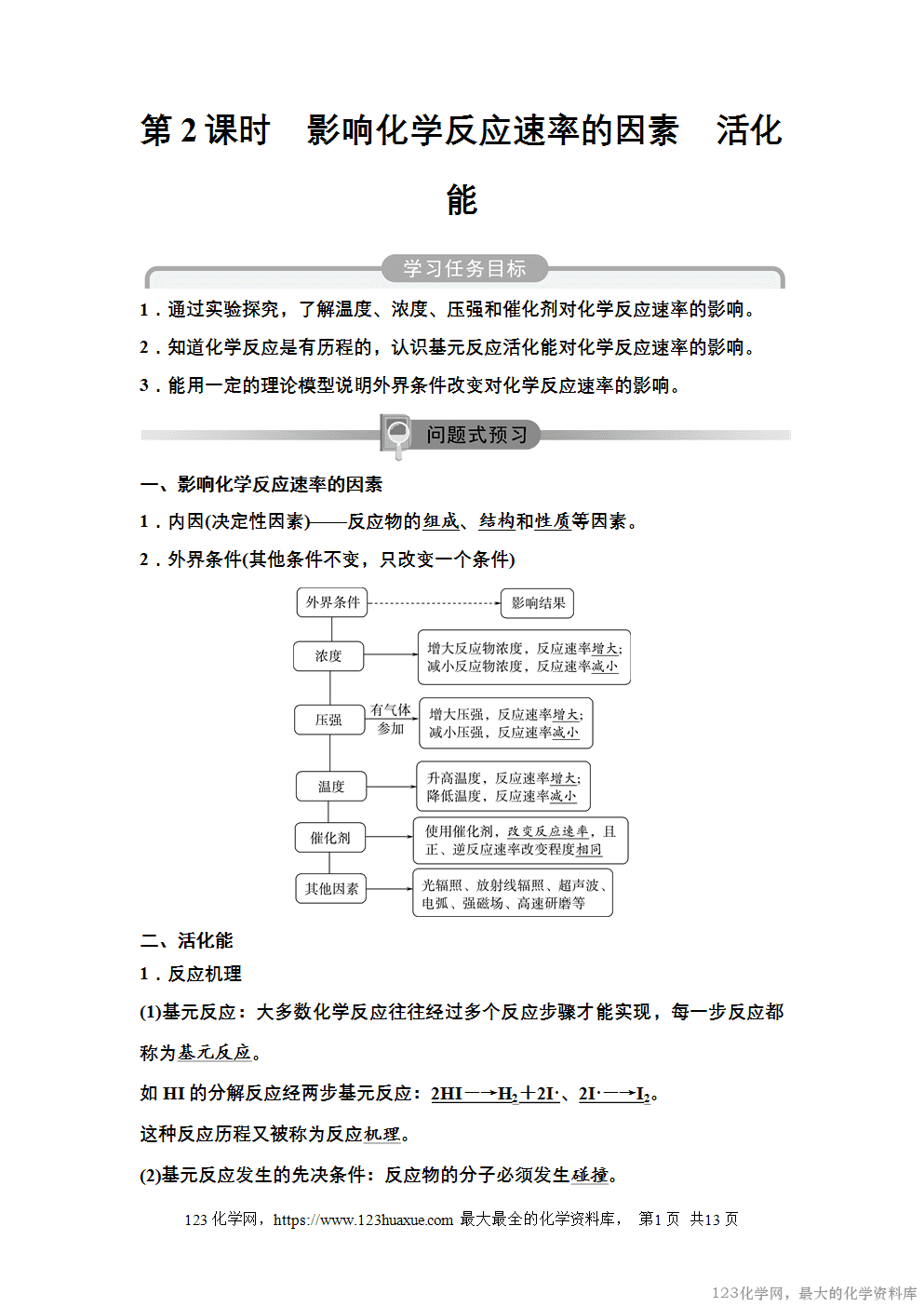
一、影响化学反应速率的因素
1.内因(决定性因素)——反应物的组成、结构和性质等因素。
2.外界条件(其他条件不变,只改变一个条件)
二、活化能
1.反应机理
(1)基元反应:大多数化学反应往往经过多个反应步骤才能实现,每一步反应都称为基元反应。
如HI的分解反应经两步基元反应:2HI―→H2+2I·、2I·―→I2。
这种反应历程又被称为反应机理。
(2)基元反应发生的先决条件:反应物的分子必须发生碰撞。
2.有效碰撞
3.活化分子和活化能
4.化学反应的过程
5.用碰撞理论解释不同条件对化学反应速率的影响
(1)浓度
反应物浓度增大→单位体积内活化分子数增多→单位时间内有效碰撞次数增加→反应速率增大;反之,反应速率减小。
(2)压强
增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数增多→单位时间内有效碰撞次数增加→反应速率增大;反之,反应速率减小。
(3)温度
升高温度→活化分子的百分数增多→单位时间内有效碰撞次数增加→反应速率增大;反之,反应速率减小。
(4)催化剂
使用催化剂→改变了反应的历程,反应的活化能降低→活化分子的百分数增加→单位时间内有效碰撞次数增加→反应速率增大。
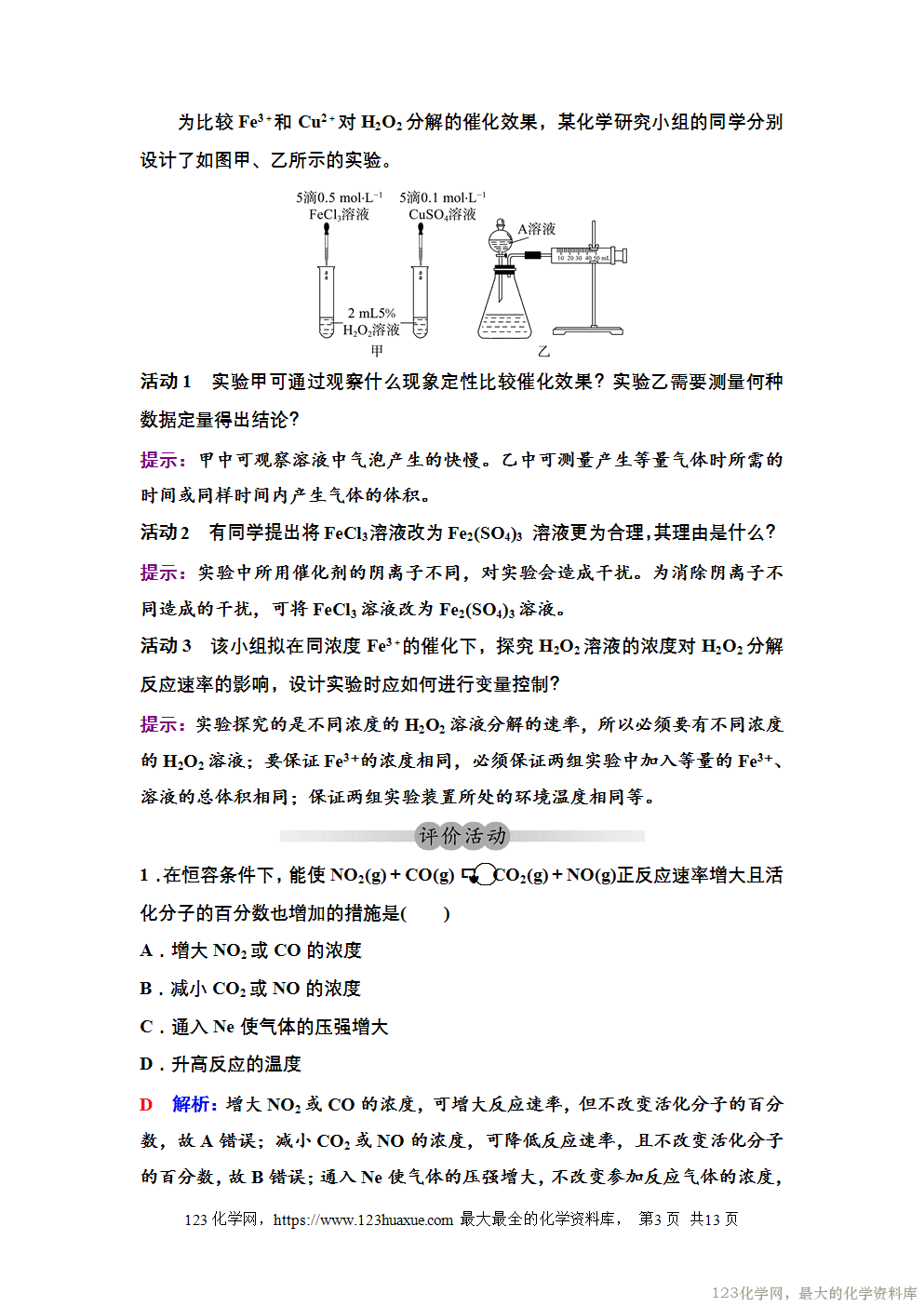
探究外界因素对反应速率的影响
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。
活动1 实验甲可通过观察什么现象定性比较催化效果?实验乙需要测量何种数据定量得出结论?