 2025~2026高中化学选择性必修1教案学案13第三章第二节第1课时水的电离溶液的酸碱性与pH
2025~2026高中化学选择性必修1教案学案13第三章第二节第1课时水的电离溶液的酸碱性与pH











一、水的电离
1.水的电离
(1)电离方程式:2H2OH3O++OH-,也可简写为H2OH++OH-。
(2)四个特点
2.水的离子积常数
(1)水的电离常数表达式为K电离=。
(2)符号:Kw。
(3)公式:Kw=c(H+)·c(OH-),在室温下,纯水中c(H+)=c(OH-)=1×10-7mol·L-1,Kw=1×10-14。
(4)影响因素:随着温度升高,水的离子积增大。
(5)适用范围:Kw不仅适用于纯水,也适用于稀的电解质溶液。
二、溶液的酸碱性与pH
1.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
(1)酸性溶液:c(H+)>c(OH-),常温下,pH<7。
(2)中性溶液:c(H+)=c(OH-),常温下,pH=7。
(3)碱性溶液:c(H+)<c(OH-),常温下,pH>7。
2.pH
(1)计算公式:pH=-lg c(H+)。
(2)溶液的酸碱性与pH的关系(室温下)
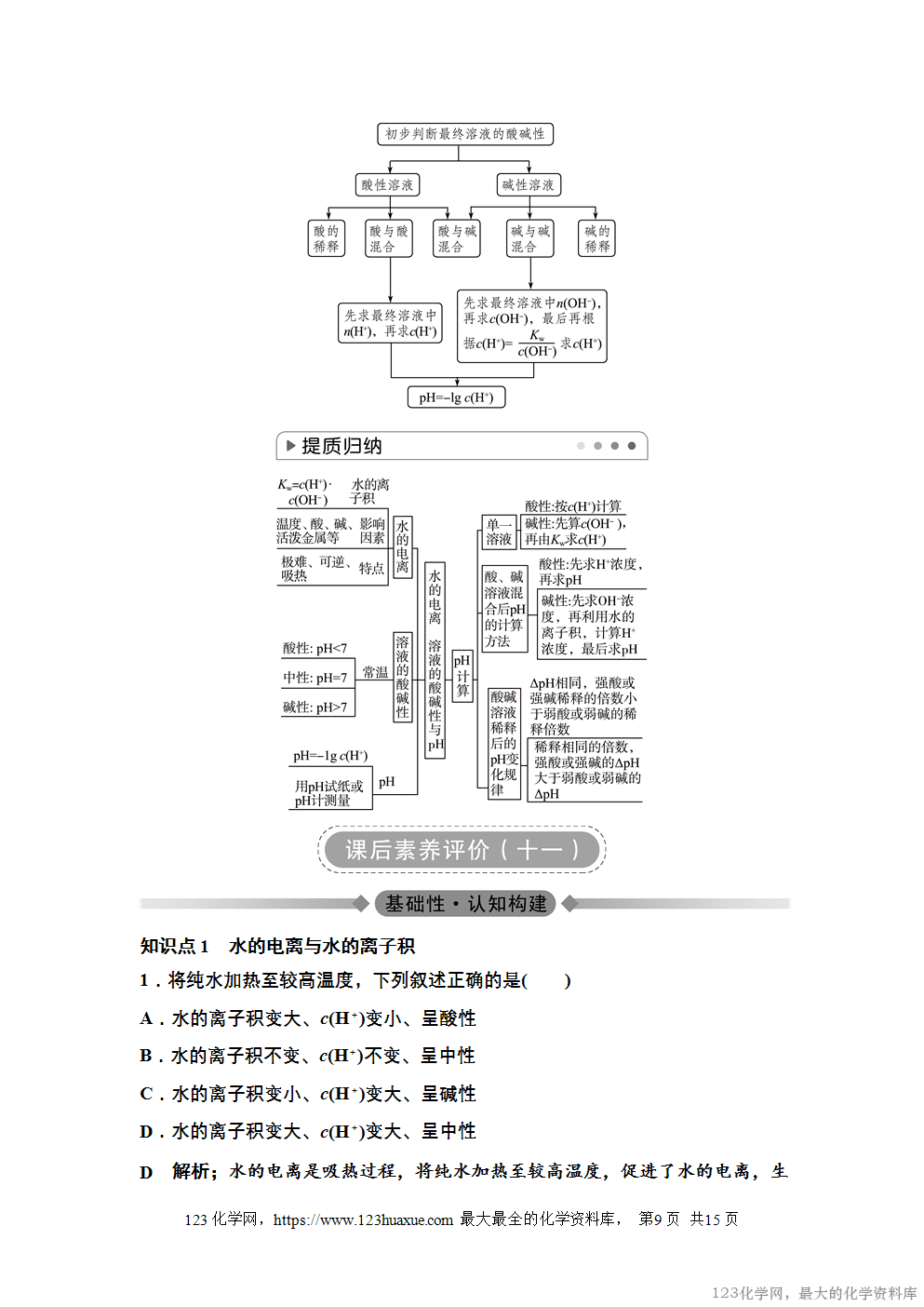
3.pH的测定方法
(1)pH试纸法
①使用方法:用镊子夹取一小块试纸放在玻璃片或表面皿上,用洁净的玻璃棒蘸取待测溶液点在试纸的中央,待变色后与标准比色卡对照,即可确定溶液的pH。
②读数:用试纸测定的pH一般取整数。
(2)pH计法:精密测量溶液的pH,测量时可以从pH计上直接读出溶液的pH。
水的电离
通常认为水是不导电的,但用精密仪器测定时,发现水有微弱的导电性,这表明水能电离出极少量的H+和OH-,以下是用电导仪测定水的电导率的装置图:
活动1 对于水的电离平衡:H2OH++OH- ΔH>0,升高温度,平衡如何移动?c(H+)、c(OH-)、Kw如何变化?
提示:向右移动,c(H+)、c(OH-)、Kw均增大。
活动2 甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,因为加入H2SO4后,c(H+)增大,平衡左移。乙同学认为,加入H2SO4后,水的电离平衡向右移动,因为加入H2SO4后,c(H+)增大,H+与OH-中和,平衡右移。你认为哪种说法正确?请说明原因。水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?
提示:甲同学的说法正确,温度不变,Kw是常数,加入H2SO4,c(H+)增大,平衡左移。c(H+)·c(OH-)不变,因为Kw仅与温度有关,温度不变,则Kw不变,与外加酸、碱、盐无关。
活动3 在水的离子积常数Kw=c(H+)·c(OH-)中,c(H+)、c(OH-)都是水电离出的c(H+)、c(OH-)吗?在酸或碱溶液中水电离出的c(H+) 与c(OH-)还相等吗?
提示:Kw=c(H+)·c(OH-)中,c(H+)、c(OH-)不一定都是水电离出来的。在酸或碱溶液中水电离出的c(H+)与c(OH-)相等。
1.下列说法正确的是( )
A.在任何条件下,纯水的pH都等于7
B.在任何条件下,纯水都呈中性