 2025~2026高中化学选择性必修1教案学案14第三章第二节第2课时酸碱中和滴定
2025~2026高中化学选择性必修1教案学案14第三章第二节第2课时酸碱中和滴定







1.理解酸碱中和滴定的原理,熟记酸碱中和滴定的实验关键,理解酸碱中和滴定的实验操作、计算方法和误差分析方法。
2.能举例说明酸碱中和滴定原理在工农业生产和科学研究中的应用。
一、酸碱中和滴定的原理及操作
1.中和滴定的概念
利用中和反应,用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的实验方法。
2.原理
(1)实质:H++OH-===H2O(填离子方程式)。
(2)原理:酸提供的H+与碱提供的OH-的物质的量相等。
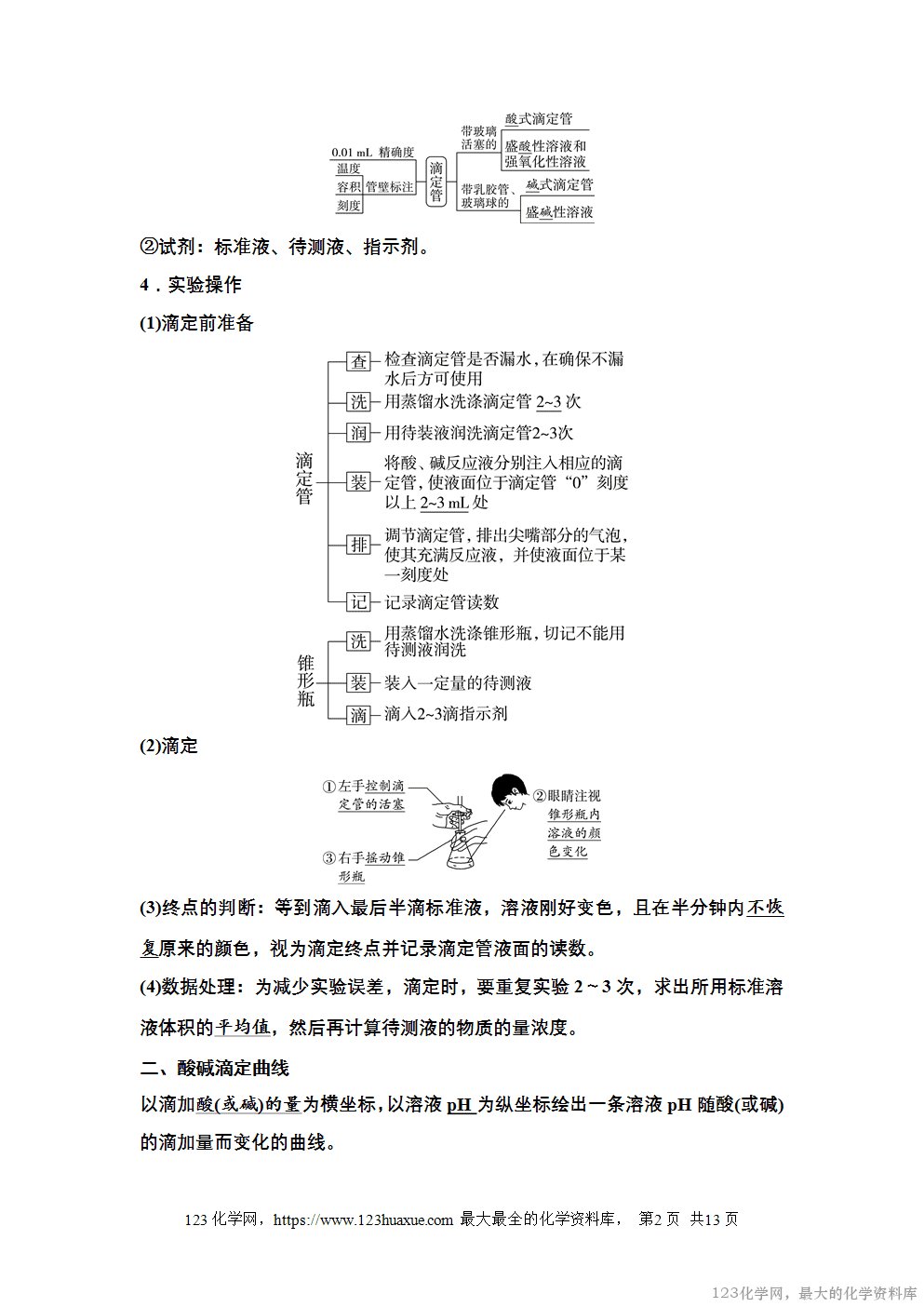
3.主要仪器及使用
(1)仪器:酸式滴定管、碱式滴定管、铁架台、滴定管夹、锥形瓶、烧杯。
(2)滴定管的结构及使用方法
①滴定管的结构
仪器A是酸式滴定管;仪器B是碱式滴定管。
②试剂:标准液、待测液、指示剂。
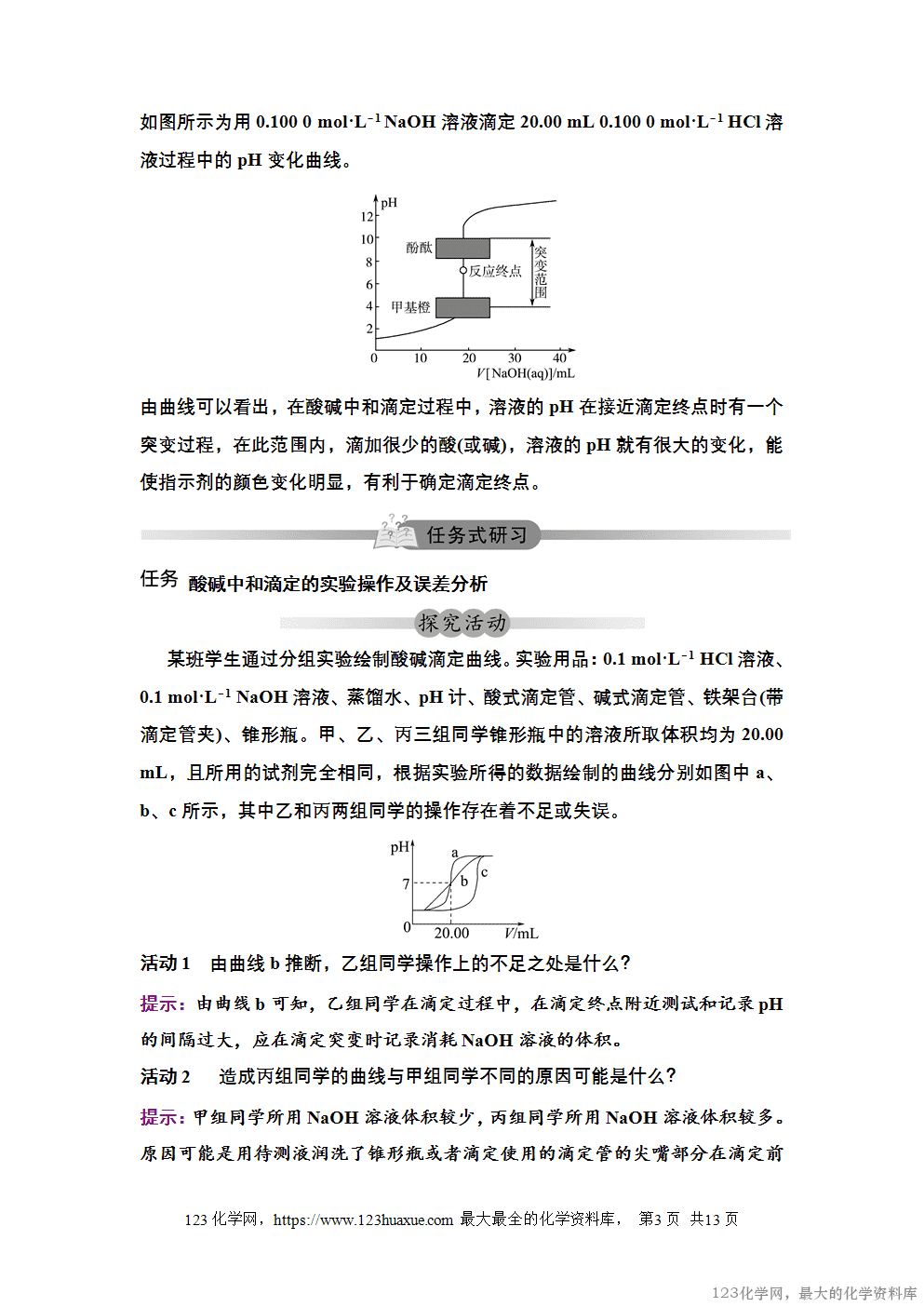
4.实验操作
(1)滴定前准备
(2)滴定
(3)终点的判断:等到滴入最后半滴标准液,溶液刚好变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录滴定管液面的读数。
(4)数据处理:为减少实验误差,滴定时,要重复实验2~3次,求出所用标准溶液体积的平均值,然后再计算待测液的物质的量浓度。
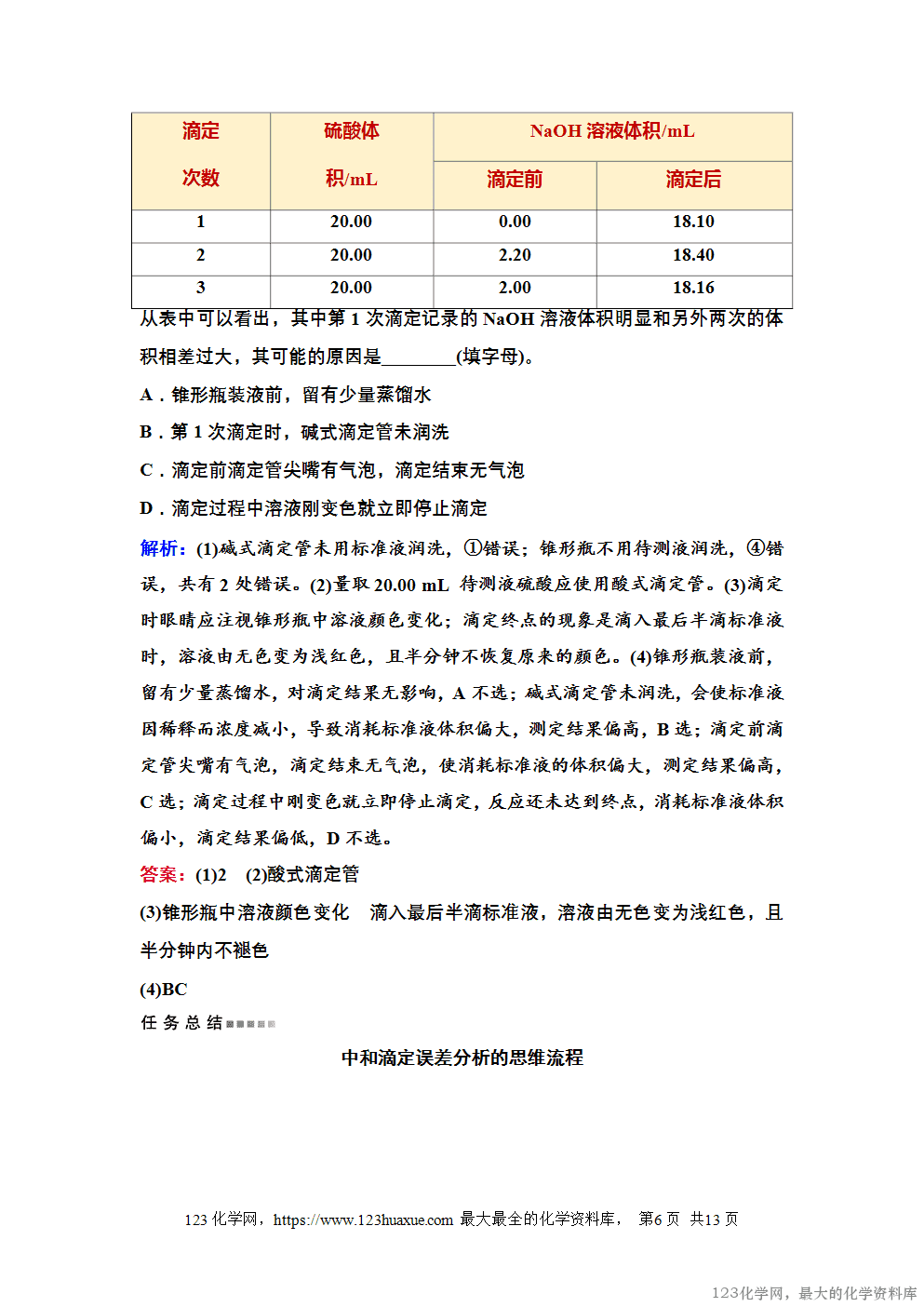
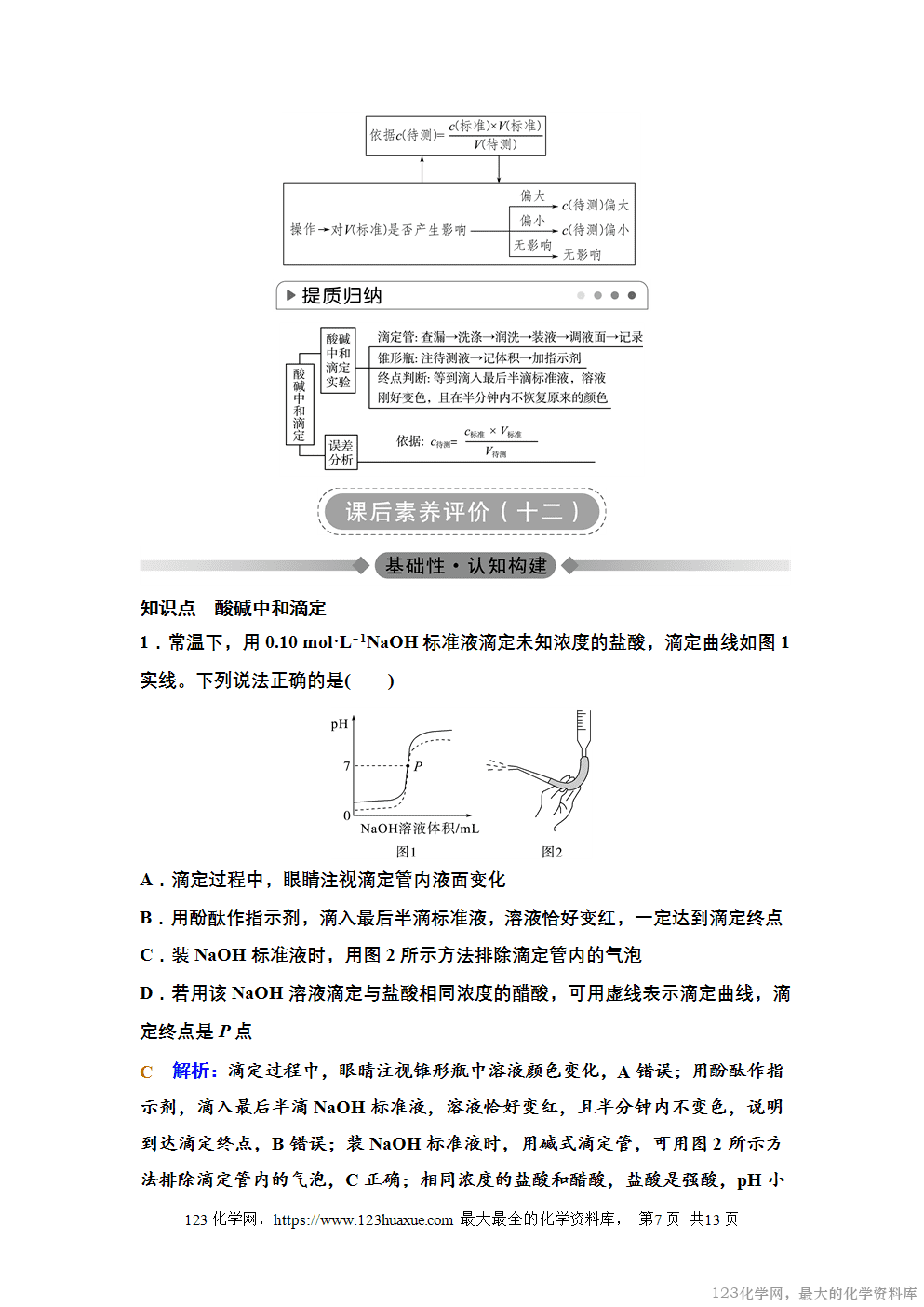
二、酸碱滴定曲线
以滴加酸(或碱)的量为横坐标,以溶液pH为纵坐标绘出一条溶液pH