
2025~2026高中化学选择性必修1教案学案19第四章第一节第1课时原电池的工作原理









1.以锌铜原电池为例,从宏观和微观的角度,分析理解原电池的工作原理,能正确判断原电池的正极和负极,会书写其电极反应,培养宏观辨识与微观探析、变化观念与平衡思想的化学核心素养。
2.认识化学能与电能的相互转化,建立对电化学过程的系统分析思路,提高对化学本质的认识。
一、原电池的构成
1.概念:将化学能转化为电能的装置称为原电池。
2.锌铜原电池装置如图所示。
缺点:原电池中氧化反应和还原反应并未完全隔开,如锌与其接触的稀硫酸发生反应,电流会逐渐衰减。
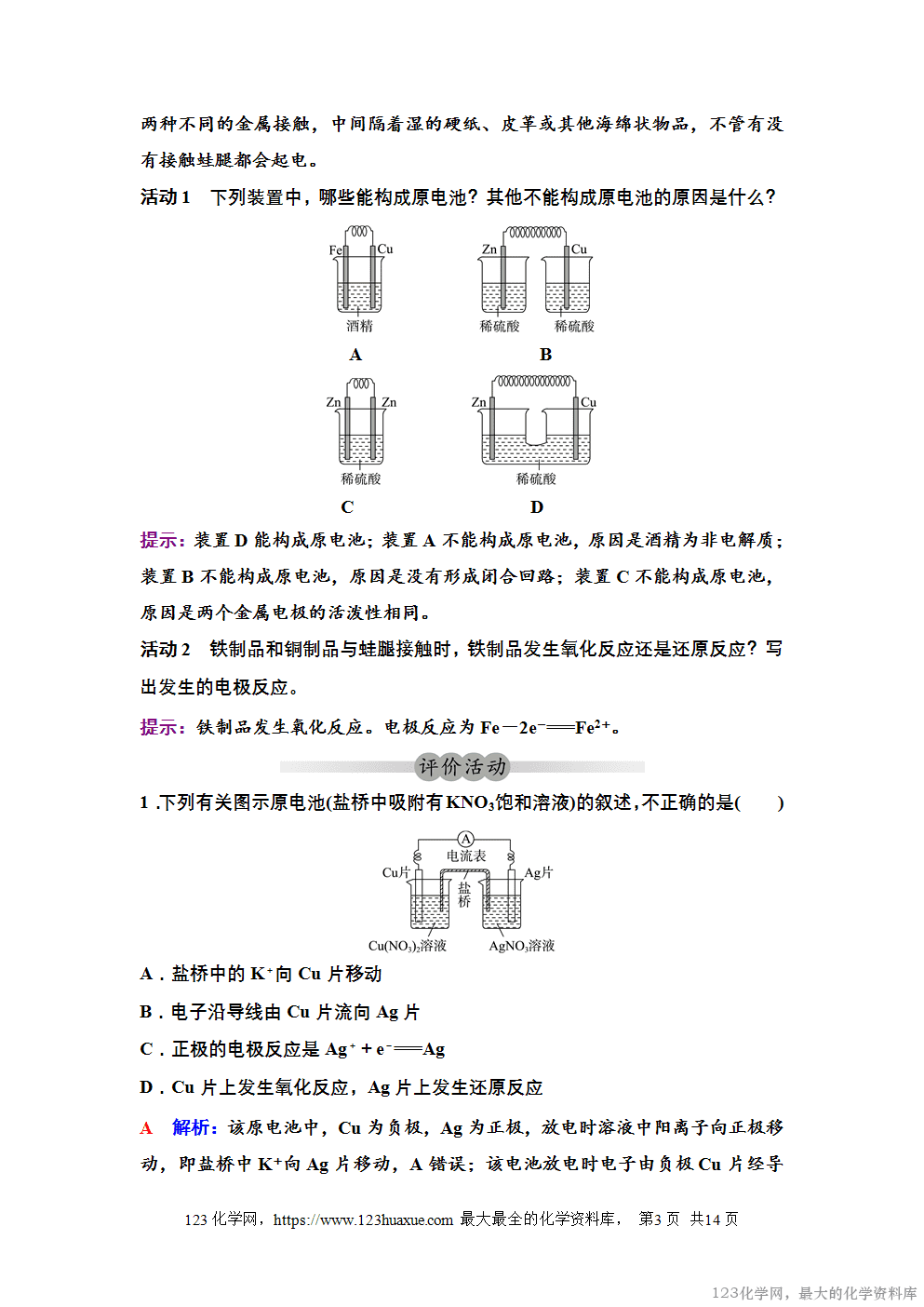
3.原电池的构成条件:①电极(活泼性不同的金属或金属与石墨等);②电解质溶液(或熔融电解质);③形成闭合回路。
二、原电池的工作原理
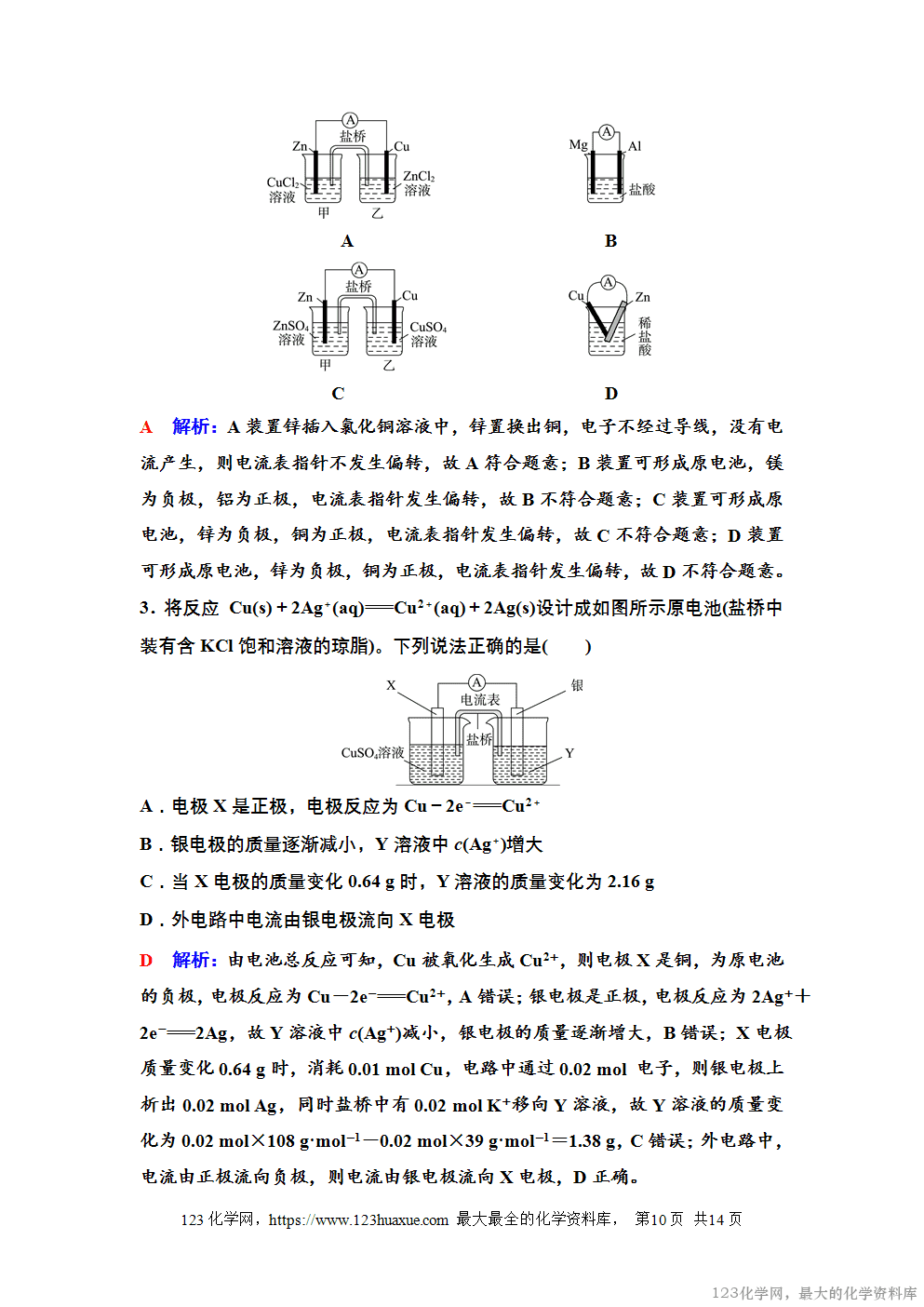
1.“双液”原电池的构成
(1)Zn和ZnSO4溶液形成负极(填“正极”或“负极”,下同),Cu和CuSO4溶液形成正极。
(2)中间通过盐桥相连接,形成闭合回路。
2.工作原理
盐桥中的Cl-移向ZnSO4溶液,K+移向CuSO4溶液,使氧化还原反应持续进行,锌铜原电池得以不断地产生电流。
三、原电池的设计
1.理论上,任何自发的氧化还原反应都可以设计成原电池。