 2025~2026高中化学选择性必修1教案学案20第四章第一节第2课时化学电源
2025~2026高中化学选择性必修1教案学案20第四章第一节第2课时化学电源











一、化学电源
1.概念
化学电源是将化学能转化为电能的装置。
2.分类
3.判断电池优劣的主要标准
(1)比能量:单位质量或单位体积所能输出电能的多少。
(2)比功率:单位质量或单位体积所能输出功率的大小。
(3)电池可储存时间的长短。
二、常见化学电源
1.一次电池
(1)负极:Zn,电极反应为Zn+2OH--2e-===Zn(OH)2。
(2)正极:MnO2,电极反应为MnO2+H2O+e-===MnO(OH)+OH-。
(3)电解质:KOH。
(4)电池总反应:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。
(5)优点:比普通锌锰电池性能好,其比能量和可储存时间均有所提高。
2.二次电池
放电时:
(1)负极:Pb,电极反应为Pb+SO-2e-===PbSO4。
(2)正极:PbO2,电极反应为PbO2+4H++SO+2e-===PbSO4+2H2O。
(3)电解质溶液:稀硫酸。
(4)电池总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
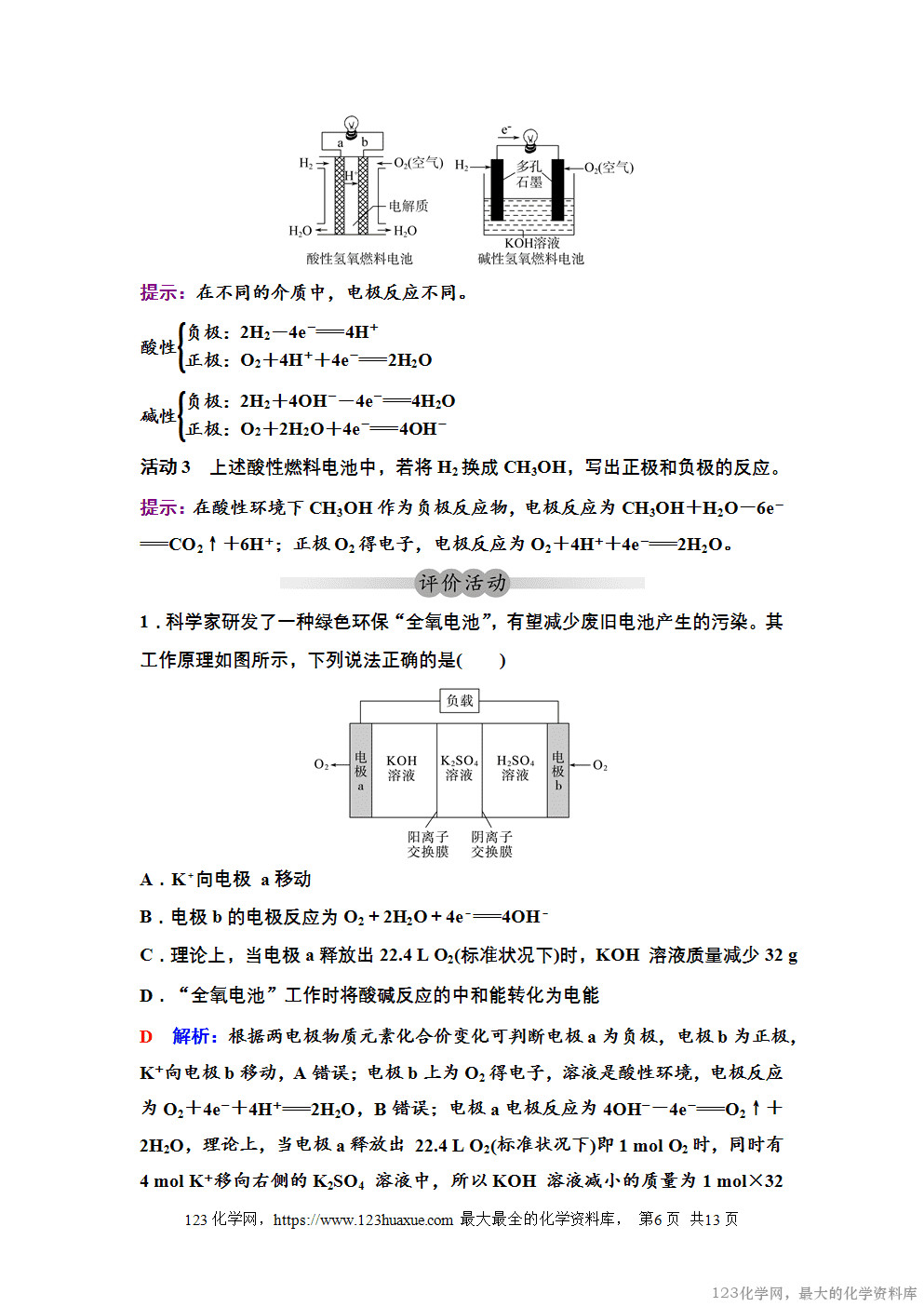
3.燃料电池
(1)负极(Pt):H2-2e-===2H+。
(2)正极(Pt):O2+2H++2e-===H2O。
(3)电解质溶液:稀硫酸。
(4)电池总反应:H2+O2===H2O。
二次电池的充、放电分析
高铁电池自20世纪90年代末问世以来,以其绿色环保、放电电压稳定、高比容量等诱人的优势成为电池领域研究新热点,具有广泛的应用前景。
高铁电池是一种可充电电池,电池的总反应为3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH。
活动1 写出该电池放电时的负极反应。
提示:放电时负极反应为Zn+2OH--2e-===Zn(OH)2。
活动2 根据该电池的总反应分析电池工作时,正极附近溶液的pH怎样变化?
提示:放电时正极附近生成OH-,溶液的碱性增强,pH变大。
活动3 给该电池充电时应该怎样连接电极?
提示:充电时该电池的正极接外接电源正极,负极接外接电源负极。
1.爱迪生蓄电池在充电和放电时发生的反应为Fe+NiO2+2H2OFe(OH)2+Ni(OH)2。下列对该蓄电池的推断,错误的是( )
①放电时,Fe参与负极反应,NiO2参与正极反应 ②放电时,电解质溶液中的阴离子向正极移动 ③放电时,负极上的电极反应为Fe+2H2O-2e-===Fe(OH)2+2H+ ④该蓄电池的电极必须浸入某种碱性电