
化学反应与电能
【学习目标】1.通过查阅资料、阅读思考,能举出化学能转化为电能的实例,辨识简单原电池的正负极及正负极上发生的化学反应类型。
2.通过实验探究、讨论交流,知道原电池概念及原电池工作原理是利用氧化还原反应将化学能转化为电能的装置,知道构成原电池的条件。
3.通过观察现象、原理分析,会判断原电池的正极、负极,能正确书写简单原电池的电极反应式,了解常见的化学电源,感受化学能转化为电能的奇妙。
【学习重点】原电池概念、原理、组成及应用
【学习难点】原电池工作原理及构成条件
【课前预习】
旧知回顾:1.氧化还原反应的特征和本质分别是什么?
【答案要点】①氧化还原反应的特征是化学反应前后有元素化合价变化;
②氧化还原反应的本质是有电子转移(电子得失或电子对偏移),氧化还原反应中氧化剂得电子,还原剂失电子,且得失电子总数相等。
2.化学反应中物质变化和能量变化有何特点?
【答案要点】①化学反应中既有物质变化,又有能量变化;
②化学反应中物质变化遵循 质量守恒定律,能量变化遵循能量守恒定律。
新知预习:1.火力发电过程中能量是如何转化的?火力发电存在哪些问题?
【答案要点】① 火力发电过程中能量是转化:化学能热能 机械能电能 ;
②火力发电的缺点:a.化石燃料属于不可再生资源,用化石燃料发电会造成资源的浪费;b.火力发电的过程中,能量经过多次转化,利用率低,能量损失大;c.化石燃料燃烧会产生大量的有害物质(如SO2、CO、NO2、粉尘等),污染环境。
2.构成原电池的条件是什么?在原电池中电子、电流的流向有何特点?
【答案要点】① 原电池构成的条件是具有活动性不同的两个电极,二者直接或间接地连在一起,插入 电解质溶液中,且能自发地发生 氧化还原 反应。
②在原电池中,电子由负极经过导线流向正极,电流由正极流向负极。在电解质溶液中阳离子移向正极,阴离子移向负极。
【课中探究】
情景导入:电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。小到日常生活中使用的手提电脑、手机、相机、摄像机……大到火箭上天、神州六号宇宙飞船遨游太空,这一切都依赖于电池的应用。播放电池的发展史(见PPT视频)
一、原电池原理及构成条件
活动一、探究化学能与电能的转化
任务一、阅读思考:阅读教材P36页内容,思考生活中人们使用的电能来自于哪里?火力发电中化学能是如何转化为电能的?有何优缺点?
【答案要点】①我国目前电能主要来自火力发电,其次来自水力发电、风力发电、核能、水力发电、生物质能等。
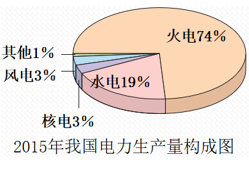
②火力发电的原理是化学能经过一系列能量转化过程,间接转化为电能: