

1.意义:化学反应速率是用来衡量化学反应过程进行快慢程度的物理量 

2.表示方法:通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示

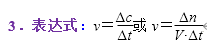
式中:Δc为浓度的变化量,一般以mol·L-1为单位;Δt为时间,一般以s或min为单位 

(1)一般来说,化学反应不是等速进行的,因此某一时间内的反应速率实际上是这一段时间内的平均速率。
(2)化学反应速率无论是用反应物还是生成物表示,其化学反应速率都为正值。
(3)固体或纯液体的浓度视为常数,Δc=0,因此不用固体或纯液体表示化学反应速率。
4.单位:mol/(L·s)、mol/(L·min)、mol/(L·h)

5.适用范围:所有的化学反应(主要是气体和溶液)

【温馨提醒】
①一般来说,随着反应的逐渐进行,反应物浓度会逐渐减小,化学反应速率也会逐渐减慢。因此,化学反应速率通常是指某一段时间内的平均反应速率,而不是瞬时反应速率

②在同一化学反应中,选用不同物质表示化学反应速率,其数值可能相同也可能不相同,但表示的意义相同,即一种物质的化学反应速率就代表了整个化学反应的反应速率

③对于一个具体的化学反应,反应物和生成物的物质的量的变化是按化学方程式中化学计量数之比进行的,所以化学反应中各物质的反应速率之比等于化学方程式中各物质的化学计量数之比

对于反应aA+bB===cC+dD (A、B、C、D均不是固体或纯液体):
 则:v(A)∶v(B)∶v(C)∶v(D)=Δn(A)∶Δn(B)∶Δn(C)∶Δn(D)=Δc(A)∶Δc(B)∶Δc(C)∶Δc(D)=a∶b∶c∶d
则:v(A)∶v(B)∶v(C)∶v(D)=Δn(A)∶Δn(B)∶Δn(C)∶Δn(D)=Δc(A)∶Δc(B)∶Δc(C)∶Δc(D)=a∶b∶c∶d

④表示化学反应速率时,必须指明用哪种物质作标准,因为同一化学反应,用不同的物质表示的反应速率,其数值可能不同。如:化学反应N2+3H2
 2NH3,用H2表示该反应的反应速率时应写成v(H2)
2NH3,用H2表示该反应的反应速率时应写成v(H2)
⑤浓度是指物质的量浓度而不是物质的量或质量分数

⑥化学反应速率与时间和浓度有关,无论是用反应物浓度的减少还是用生成物浓度的增加来表示,都取正值

⑦在一定温度下,对于固体和纯液体物质来说,其单位体积里的物质的量不会改变,即它们的物质的量浓度为常数,即Δc=0(无意义),所以不用固体或纯液体表示反应速率


1.定性比较
通过明显的实验现象,如反应的剧烈程度、产生气泡或沉淀的快慢、固体消失或气体充满所需时间的长短等来定性判断化学反应的快慢。如K与水反应比Na与水反应剧烈,则反应速率:K>Na。
2.定量比较
同一化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,还要进行一定的转化。
(1) “一看”:看化学反应速率的单位是否一致,若不一致,转化为同一单位。
(2) “二化”:将不同物质的化学反应速率转化成同一物质的化学反应速率,或分别除以相应物质的化学计量数。
(3) “三比较”:标准统一后比较数值大小,数值越大,反应速率越大。
word文档共24页,完整文件请下载后使用......