





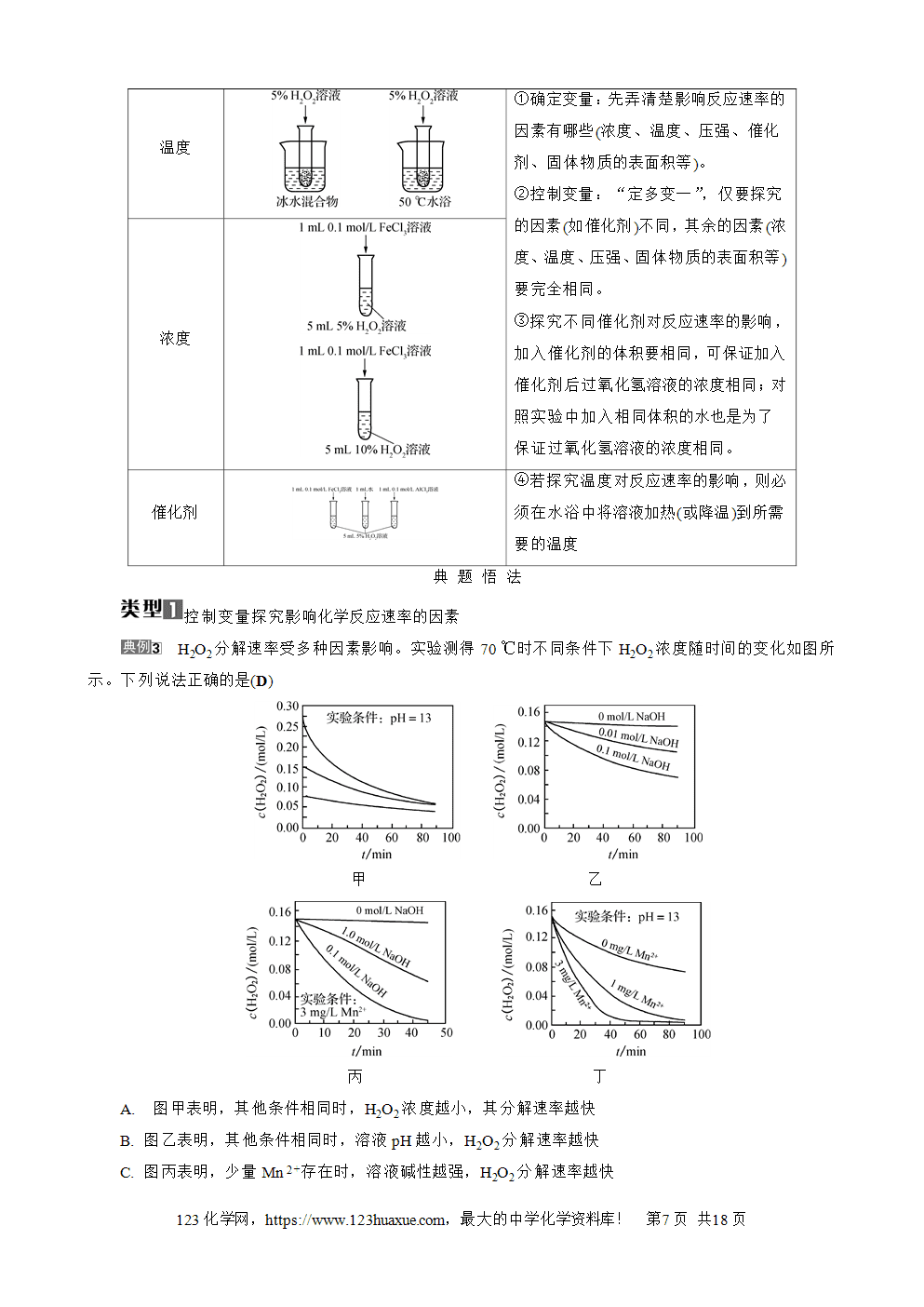


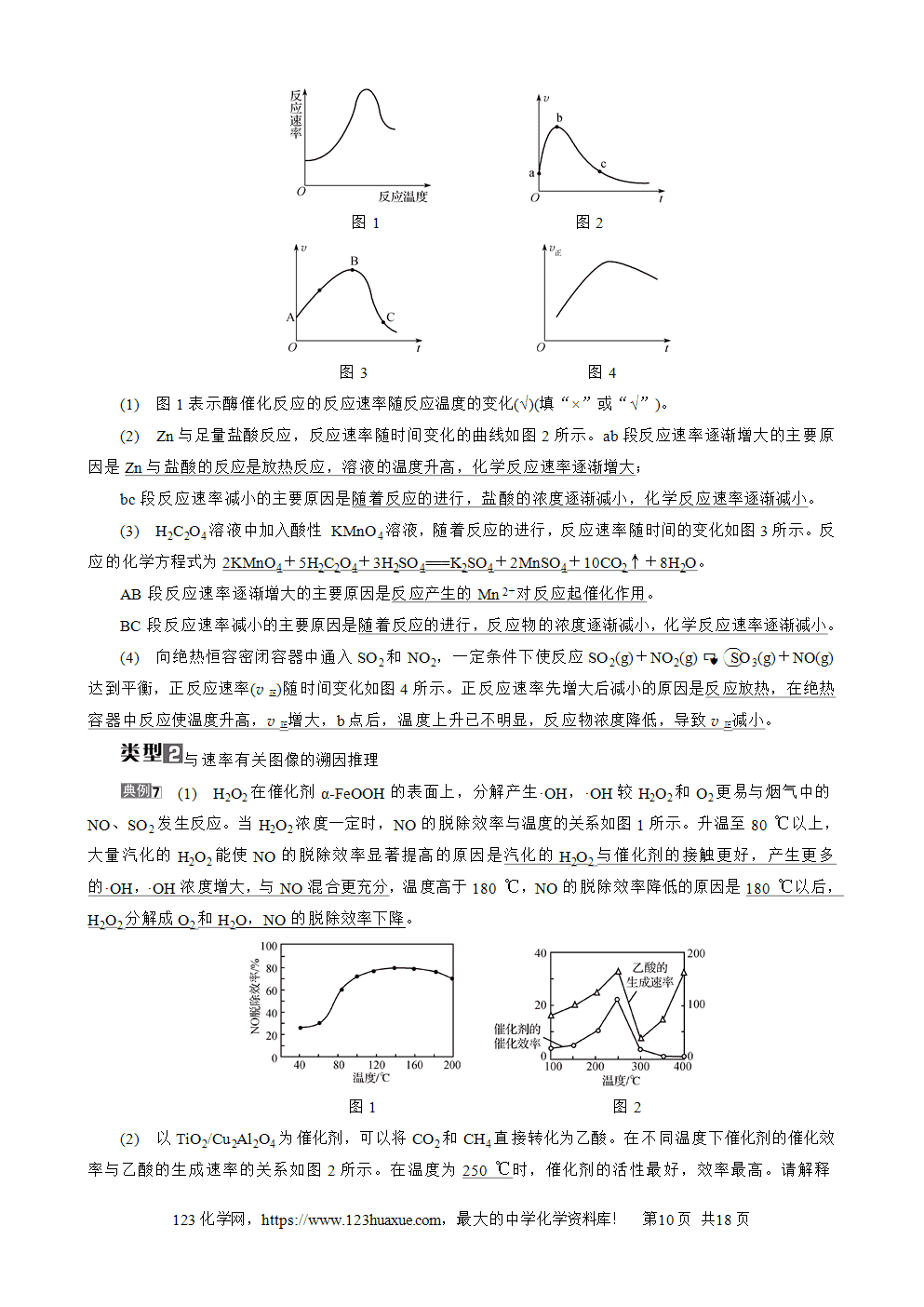


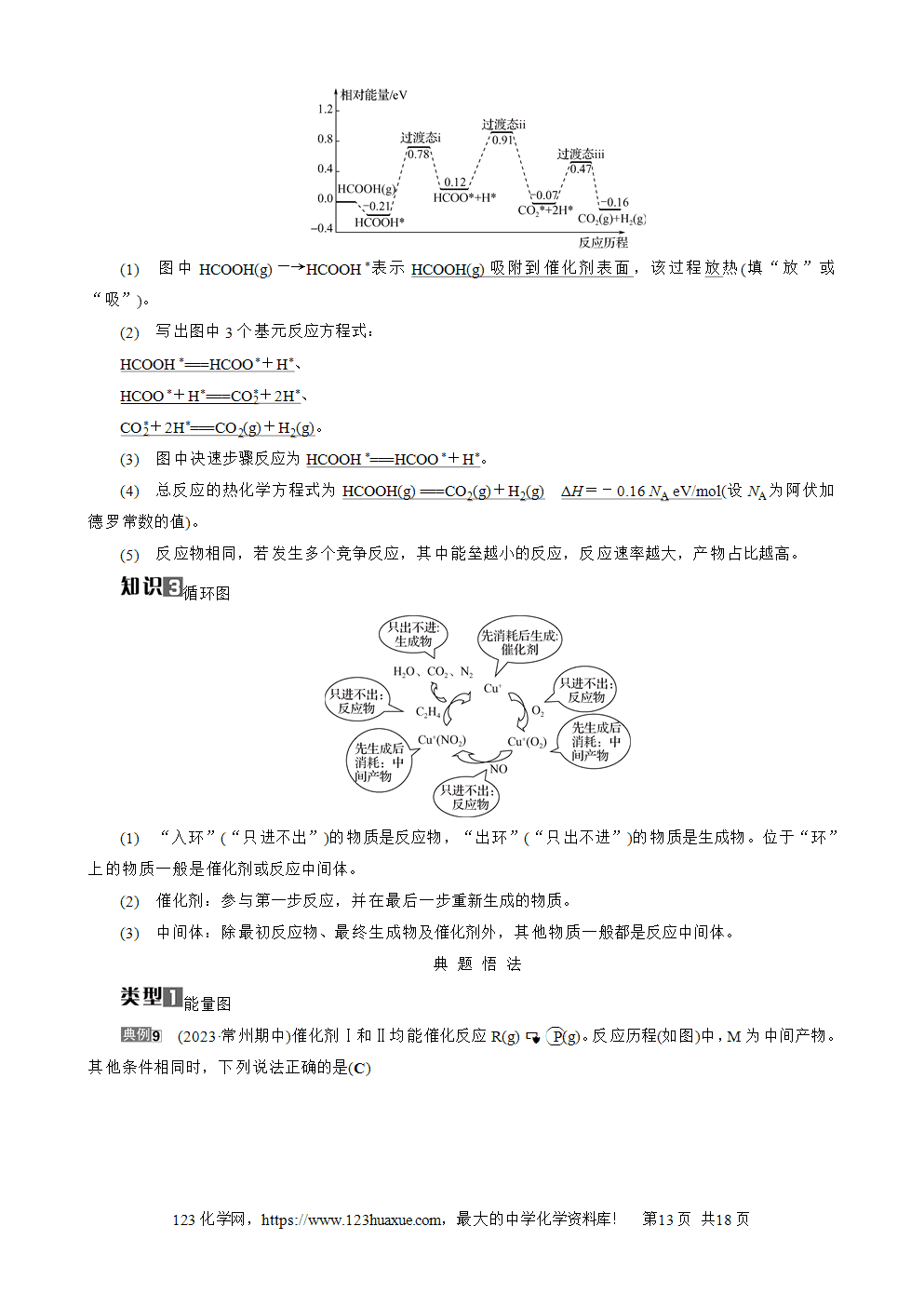

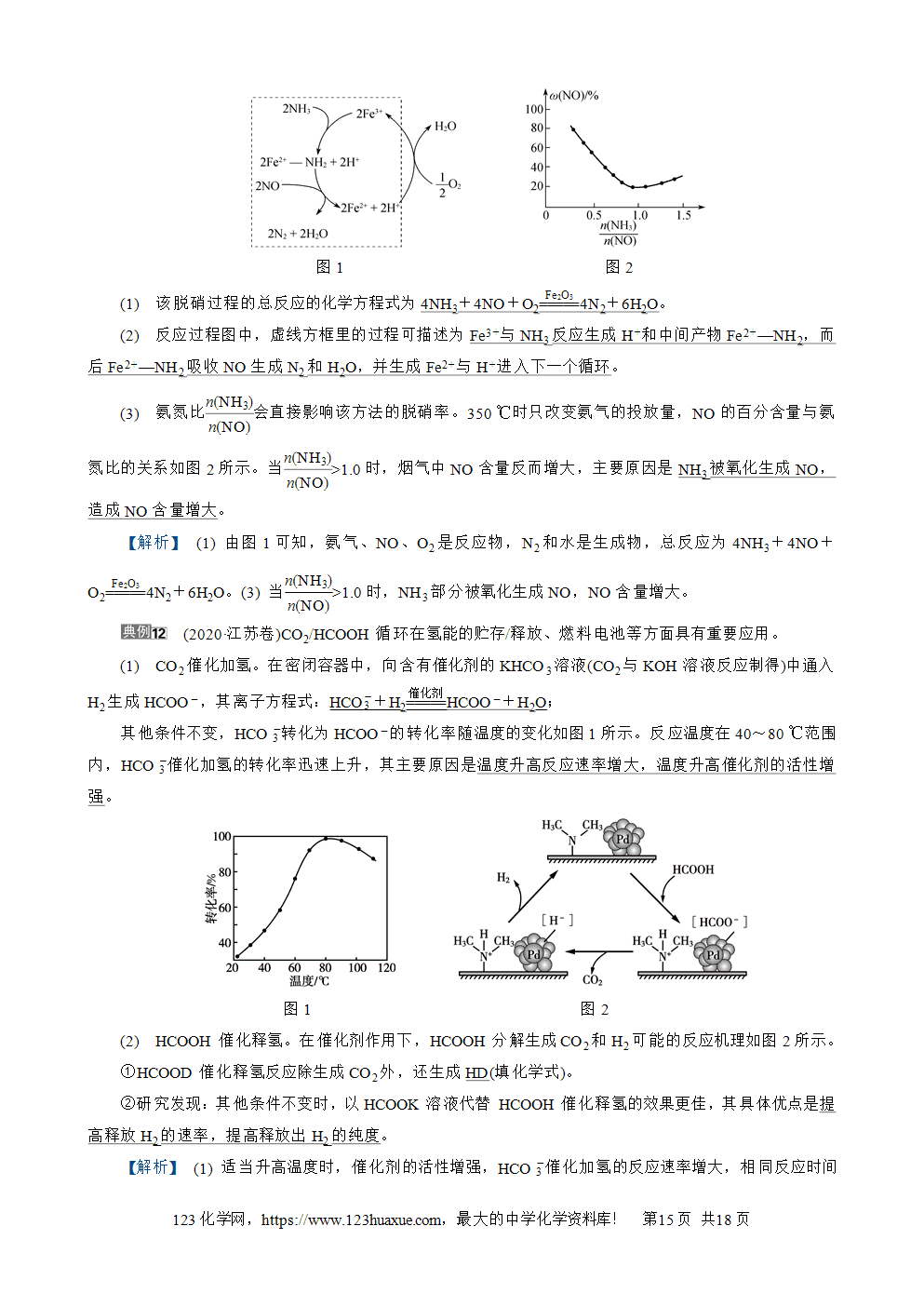

化学反应速率
1. 定义:单位时间内反应物浓度的减少或生成物浓度的增加。
计算公式:v=Δt(Δc);
单位:mol/(L·min)或mol/(L·s),该速率为平均反应速率。
2. 浓度变化只适用于气体和溶液中的溶质,固体和纯液体的浓度视为常数。
3. 在同一化学反应中:aA(g)+bB(g)===cC(g)+dD(g),v(A)∶v(B)∶v(C)∶v(D)=a∶b∶c∶d,此处的速率为平均反应速率。
4. 化学反应速率大小比较的方法
如:X(g)+3Y(g)2Z(g),v(X)=0.5 mol/(L·s)、v(Y)=1.2 mol/(L·s)、v(Z)=0.6 mol/(L·s)。反应速率最大的是v(X)。
(1) 归一法:将三种物质的速率均换算成以X表示的速率,分别为0.5 mol/(L·s)、0.4 mol/(L·s)、0.3 mol/(L·s),数值越大,反应速率越大,故v(X)最大。
(2) 比值法:化学反应速率与化学计量数的比值越大,反应速率越大,由于()1(vX)>()3(vY)>()2(vZ),故v(X)最大。
质量作用定律
1. 基元反应:反应物分子一步直接转化为产物的反应。
2. 对于基元反应aA(g)+bB(g)===gG(g)+hH(g),其速率方程可写为v=k·ca(A)·cb(B)(其中k为速率常数,恒温下,k不因反应物浓度的改变而发生变化)。这种关系可以表述为一定温度下,基元反应的化学反应速率与反应物浓度以其化学计量数为指数的幂的连乘积成正比(有时称其为质量作用定律)。
3. 许多化学反应,尽管其化学方程式很简单,却不是基元反应,而是经由两个或多个步骤完成的复杂反应。
如:H2(g)+I2(g)===2HI(g),它的反应历程可能是如下两步基元反应:
①I2===2·I(快);②H2+2·I===2HI(慢)。其中慢反应为整个反应的决速步骤。
典 题 悟 法
化学反应速率
取50 mL过氧化氢水溶液,在少量I-存在下分解:2H2O2===2H2O+O2↑。在一定温度下,测得O2的放出量,转换成H2O2浓度(c)如下表: