

1.自发过程 
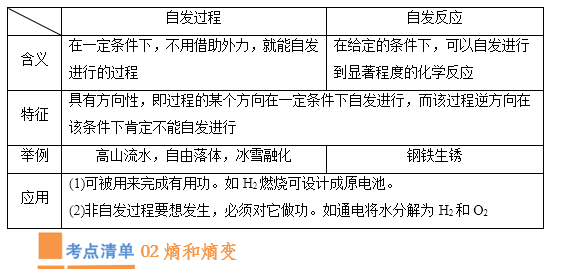
(1)含义:在一定条件下,不用借助外力,就能自发进行的过程。
(2)特点
①能量角度:体系趋向于从高能状态转变为低能状态(体系对外部做功或者放出热量)
②混乱度角度:在密闭条件下,体系有从有序自发转变为无序的倾向
③具有方向性:即过程的某个方向在一定条件下自发进行,而该过程逆方向在该条件下肯定不能自发进行
2.自发反应
(1)定义:在给定条件下,可以自发地进行到显著程度的化学反应。如:食品腐败
(2)自发反应的特征
①具有方向性,即反应的某个方向在一定条件下是自发的,则其逆反应在该条件下肯定不自发,如: 食物在常温下会腐败,但是由腐败的食物变为食物是不可能自发进行的。
②体系趋向于从高能量状态转变为低能量状态 。如:煤炭在一定条件下会自发燃烧成低能量的二氧化碳。
。如:煤炭在一定条件下会自发燃烧成低能量的二氧化碳。
③体系趋向于从有序体系转变为无序体系。如:老师离开教室后,学生在无约束的状态下会自发地由有序的状态进入混乱的状态 。
。
(3)应用
①可被用来完成有用功。如:设计原电池
②非自发过程要想发生,必须对它做功。如:通电将水分解为H2和O2
【温馨提醒】
①自发反应也需要一定条件引发反应,一旦反应后即可自发进行。如:碳的燃烧需要点燃。
②一般的,如果一个过程是自发的,则其逆过程就是非自发的。非自发过程要想发生,则必须对它做功,如利用水泵可将水从低处抽向高出,通电可将水分解生成氢气和氧气。
③判断某反应是否自发,只是判断反应的方向,与是否会发生、反应的快慢、反应的热效应无关。
3.自发过程的判断
(1)根据条件判断:不是看是否需要条件,而是看是否需要持续施加外力(如加热等)
(2)根据其逆向过程是否自发判断:若逆向过程自发,则正向过程一定不自发;若逆向过程不自发,则正向过程一定自发。
1.熵
(1)定义:熵是衡量体系混乱度大小的物理量。
(2)符号和单位:S,常用单位:J/(mol·K)
2.熵变
(1)定义:发生化学反应时物质熵的变化称为熵变,符号为ΔS
(2)计算公式:ΔS=生成物总熵-反应物总熵
3.影响熵大小的因素 
(1)同一条件下,不同的物质熵值不同
(2)同一物质的熵与其聚集状态及外界条件有关,对同一种物质不同状态时熵值大小为S(g)>S(l)>S(s)
(3)不同物质熵值的关系:
I、物质组成越复杂→熵值越大
II、对于原子种类相同的物质:分子中原子数越多→熵值越大
(4)物质的量越大,分子数越多,熵值越大
(5)反应过程中气体物质的量增加的反应是熵增大
(6)固体的溶解过程、墨水扩散过程和气体扩散过程是熵增大
4.熵判据——自发反应与熵变的关系
多数能自发进行的化学反应是熵增的反应。熵变是与反应进行方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。因此,只根据熵变来判断反应进行的方向是不全面的。
本word文档共25页,完整内容请下载资料使用......