








一、选择题
1.(2019·福建省尤溪第一中学高一月考)下列关于氯及其化合物的叙述正确的是( )
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.实验室制取氯气时,为了防止环境污染,多余的氯气可以用饱和食盐水吸收
C.久置的氯水没有漂白性
D.检验HCl气体中是否混有的方法是将气体通入硝酸银溶液
【答案】C
【解析】A. 氯气的性质很活泼,它与氢气混合后在关照的条件下发生爆炸,故A错误;B. 实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收,故B错误;C. 久置的氯水中,次氯酸分解,没有漂白性,故C正确;D. HCl气体及通入硝酸银溶液,均能生成白色氯化银沉淀,故D错误;故选C。
2.下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H++CO32-===CO2↑+H2O
B.钠与水反应:Na+2H2O=Na++2OH-+H2↑
C.将稀硫酸滴在铜片上: Cu+2H+=Cu2++H2↑
D.有效成分为的消毒液与有效成分为浓的洁厕灵混用产生黄绿色气体:
【答案】D
【解析】A. 大理石是碳酸钙,不溶于水,不能拆成离子形式,故离子方程式2H++CO32-===CO2↑+H2O是错误的,故错误;B. 电荷不守恒,应为:2Na+2H2O=2Na++2OH-+H2↑,A项错误;C. 铜与稀硫酸不反应,故错误;D.二者在酸性条件下发生氧化还原反应,离子方程式符合反应事实,遵循电子守恒、电荷守恒、原子守恒,D正确;故合理选项是D。
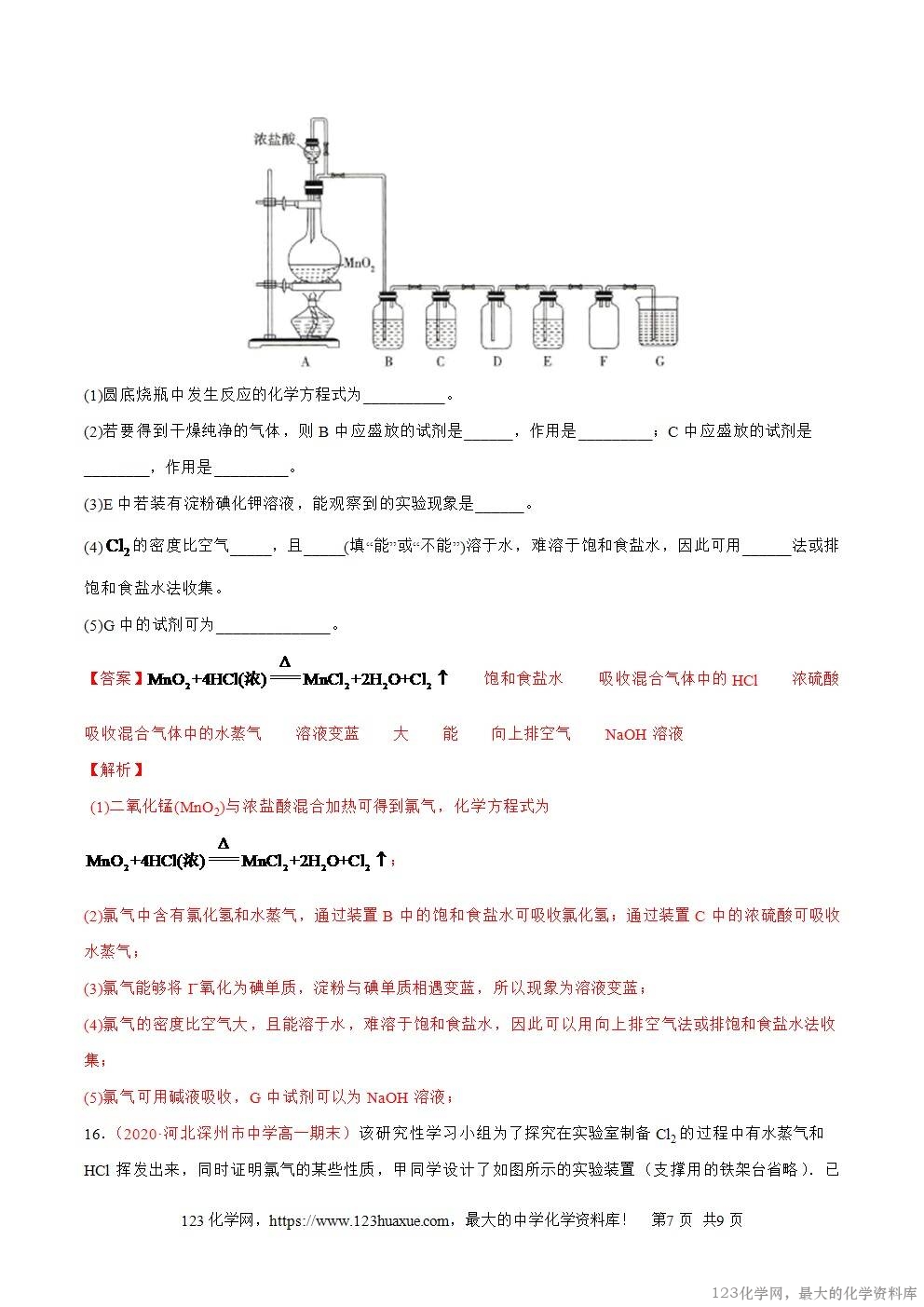
3.(2020·衡东县欧阳遇实验中学高一期末)下列除去杂质的实验方法正确的是
A.除去Cl2中的少量HCl:通过饱和NaHCO3溶液,收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
D.除去氢氧化铁胶体中的Cl-:渗析
【答案】D
【解析】A. Cl2通过饱和NaHCO3溶液,发生反应Cl2+H2O⇌HCl+HClO,NaHCO3+HCl=NaCl+CO2+H2O,因此氯气会被饱和NaHCO3溶液吸收,故A错误;B. NaHCO3受热分解生成Na2CO3,因此不能得到纯净的K2CO3,故B错误;C. 加入适量NaOH溶液生成NaCl,引入新杂质,故C错误;D. 胶体粒子不能透过半透膜,而离子能透过半透膜,故除去氢氧化铁胶体中的Cl-可用渗析的方法,故D正确,故选D。
4.(2020·云南省高一期末)实验室用浓盐酸和二氧化锰制氯气。下列说法错误的是
A.浓盐酸在该反应中表现出酸性和还原性
B.该方法是瑞典化学家舍勒最先发现的
C.该反应的氧化产物是二氯化锰,还原产物是氯气
D.该反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
【答案】C
【解析】实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,据此回答问题。A.有分析中的方程式可知,一部分氯元素的化合价从-1价升高到0价,作还原剂,具有还原性,还有一部分氯元素的化合价没有变化,生成盐和水,所以浓盐酸在该反应中表现出酸性和还原性,故A正确,但不符合题意;B. 实验室用浓盐酸和二氧化锰制氯气,是瑞典化学家舍勒最先发现的,故B正确,但不符合题意;C. 该反应的氧化产物是氯气,还原产物是二氯化锰,故C错误,符合题意;D.二氧化锰和水是氧化物,不能拆成离子的形式,氯化氢和氯化锰是可溶于水的强电解质,拆成离子的形式,氯气是单质,写化学式,该反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,符合电荷守恒,客观事实,原子守恒,故D正确,但不符合题意;
故选:C。