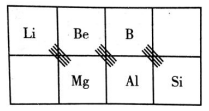
1.概念:在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物),这种相似性被称为对角线规则,如图所示。
【特别提醒】对角线规则是从相关元素及其化合物的许多性质中总结出来的经验规则,不是定理。
2.锂和镁的相似性
(1)锂与镁的沸点较为接近:

(2)在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物,并且Li2O和MgO与水反应都十分缓慢。
4Li+O2点燃2Li2O、2Mg+O2点燃2MgO
(3)能直接与氮气反应:生成相应的氮化物Li3N和Mg3N2。
(4)锂和镁的氢氧化物加热分解:分别生成Li2O、H2O和MgO、H2O。
(5)在碱金属的氟化物、碳酸盐和磷酸盐中:只有锂盐是难溶于水的,相应的镁盐也难溶于水。
3、铍和铝的相似性
(1)二者的氧化物Al2O3和BeO的熔点和硬度都很高;
(2)都可与酸、碱反应放出氢气;
(3)铍在浓硝酸中也发生钝化;
(4)氧化物和氢氧化物都具有两性,既能溶于强酸又能溶于强碱溶液:Be(OH)2+2HCl=BeCl2+2H2O,
Be(OH)2+2NaOH=Na2BeO2+2H2O;
(5)BeCl2和AlCl3都是共价化合物,易升华。
4、硼和硅的相似性
(1)自然界中B与Si均以化合物的形式存在。
(2)B与Si的单质都易与强碱反应,且不与稀酸反应:Si+2KOH+H2O= K2SiO3+2H2↑,2B+2KOH+2H2O = 2KBO2+3H2↑。