1.构造原理
(1)内容:以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
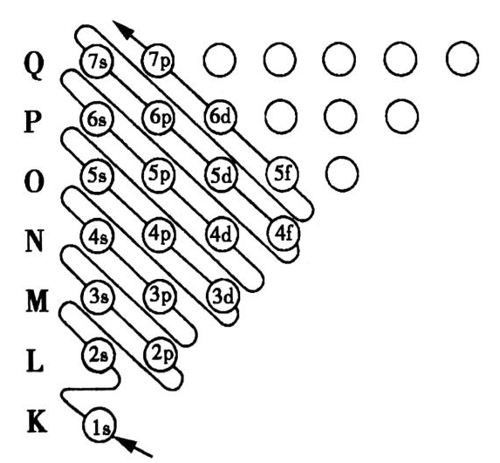
(2)构造原理示意图:图中用小圆圈表示一个能级,每一行对应一个能层,箭头引导的曲线显示递增电子填入能级的顺序。
注:电子填充的常见一般规律:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s
(3)能级交错:构造原理告诉我们,随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的。这种现象被称为能级交错。
注:①构造原理呈现的能级交错源于光谱学事实,是经验的,而不是任何理论推导的结果。构造原理是一个思维模型,是个假想过程。
②能级交错现象是电子随核电荷数递增而出现的填入电子顺序的交错,并不意味着先填的能级能量一定比后填的能级能量低
2.电子排布式
(1)定义:电子排布式是用核外电子分布的能级及各能级上的电子数来表示电子排布的式子。
(2)表示方法:
(3)书写方法——“三步法”(构造原理是书写基态原子电子排布式的主要依据)
第一步:按照构造原理写出电子填入能级的顺序,1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s
第二步:根据各能级容纳的电子数填充电子。
第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。
注:(1)在书写电子排布式时,一般情况下,能层低的能级要写在左边,而不是按构造原理的顺序写。
(4)在得出构造原理之前,由原子光谱得知有些过渡金属元素基态原子电子排布不符合构造原理,如Cr和Cu的最后两个能级的电子排布分别为3d54s1和3d104s1。由此可见,构造原理是被理想化了的。
(5)简化电子排布式
①定义:将原子中已经达到稀有气体元素原子结构的部分,用相应的稀有气体元素符号外加方括号表示的式子称为简化电子排布式。
②表示方法:如氮、钠、钙的简化电子排布式分别为[He]2s22p3、[Ne]3s1 、[Ar]4s2。
(6)价层电子排布式
①价电子层的定义:为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。
②价电子的位置:
对于主族元素和零族元素来说,价电子就是最外层电子。表示方法:nsx或nsxnpy
对于副族和第VIII族元素来说,价电子除最外层电子外,还可能包括次外层电子。
表示方法:(n-1)dxnsy 或 ndx (钯4d10) 或 (n-2)fx(n-1)dynsz 或(n-2)fxnsy
③举例:元素周期表中给出了元素的价层电子排布式。如Cl的价层电子排布式为3s23p5,Cr的价层电子排布式为3d54s1。
【思考与讨论p11】参考答案:
(1)氦:1s2 氖:2s22p6 氩:3s23p6 氪:4s24p6 氙:5s25p6 氡:6s26p6 :7s27p6
除氦外的通式:ns2np6(n为周期数)。
(2)方括号里的符号表示内层电子排布达到稀有气体结构的部分(如钠的电子排布式中的[Ne]表示1s22s22p6)。氧的简化电子排布式为[He]2s22p4,硅的简化电子排布式为[Ne]3s23p2,铜的简化电子排布式为[Ar]3d104s1。
(3)价层电子排布:Na :3s1 Al :3s23p1 Cl: 3s23p5 Mn:3d54s2 Br: 4s24p5。