1.电子自旋
(1)定义:电子除空间运动状态外,还有一种状态叫做自旋。电子自旋可以比喻成地球的自转。
(2)两种取向及表示方法:电子自旋在空间有顺时针和逆时针两种取向。常用方向相反的箭头“↑”和“↓”表示自旋状态相反的电子。
注:①自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
②能层、能级、原子轨道和自旋状态四个方面共同决定电子的运动状态,电子能量与能层、能级有关,电子运动的空间范围与原子轨道有关
③一个原子中不可能存在运动状态完全相同的2个电子。
2、泡利原理
在一个原子轨道里,最多只能容纳2个电子,它们的自旋相反,这个原理被称为泡利原理(也称为泡利不相容原理)。
3、电子排布的轨道表示式
(1)含义:轨道表示式(又称电子排布图)是表述电子排布的一种图式。
举例:如氢和氧的基态原子的轨道表示式:
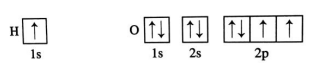
(2)书写要求:
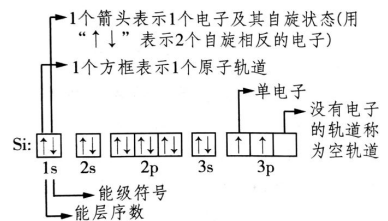
①在轨道表示式中,用方框(也可用圆圈)表示原子轨道,1个方框代表1个原子轨道,通常在方框的下方或上方标记能级符号。
②不同能层及能级的原子轨道的方框必须分开表示,能量相同(同一能层相同能级)的原子轨道(简并轨道)的方框相连。
③箭头表示一种自旋状态的电子,“↑↓”称电子对,“↑”或 “↓”称单电子(或称未成对电子);箭头同向的单电子称自旋平行,如基态氧原子有2个自旋平行的2p电子。
④轨道表示式的排列顺序与电子排布式顺序一致,即按能层顺序排列。有时画出的能级上下错落,以表达能量高低不同。
⑤轨道表示式中能级符号右上方不能标记电子数。
(3)书写方法:以Si原子为例,说明轨道表示式中各部分的含义:
4.洪特规则
(1)内容:基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,称为洪特规则。
注: ①洪特规则只针对电子填入简并轨道而言,并不适用于电子填入能量不同的轨道。
②当电子填入简并轨道时,先以自旋平行依次分占不同轨道,剩余的电子再以自旋相反依次填入各轨道。
(2)特例:简并轨道上的电子排布处于全充满、半充满和全空状态时,具有较低的能量和较高的稳定性。
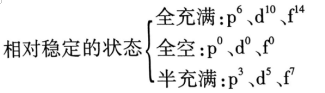
举例:如基态24Cr的电子排布式为1s22s22p63s23p63d54s1,为半充满状态,易错写为1s22s22p63s23p63d44s2 ;
基态29Cu的电子排布式为[Ar]3d104s1,易错写为[Ar]3d94s2。
5.能量最低原理
(1)内容:在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理。
(2)说明:
①基态原子的能量最低,故基态原子的电子排布是能量最低的原子轨道组合。
②整个原子的能量由核电荷数、电子数和电子状态三个因素共同决定,相邻能级能量相差很大时,电子填入能量低的能级即可使整个原子能量最低(如所有主族元素的基态原子);而当相邻能级能量相差不太大时,有1~2个电子占据能量稍高的能级可能反而降低了电子排斥能而使整个原子能量最低(如所有副族元素的基态原子)。
③基态原子的核外电子排布遵循泡利原理、洪特规则和能量最低原理。