1.电子云
(1)概率密度:用P表示电子在某处出现的概率,V表示该处的体积,则称为概率密度,用ρ表示。
(2)电子云:由于核外电子的概率密度分布看起来像一片云雾,因而被形象地称作电子云。换句话说,电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述。
注:①电子云图表示电子在核外空间出现概率的相对大小。电子云图中小点越密,表示电子出现的概率越大。
②电子云图中的小点并不代表电子,小点的数目也不代表电子实际出现的次数。
③电子云图很难绘制,使用不方便,故常使用电子云轮廓图。
(3)电子云轮廓图:
①绘制电子云轮廓图的目的:表示电子云轮廓的形状,对核外电子的空间运动状态有一个形象化的简便描述。例如,绘制电子云轮廓图时,把电子在原子核外空间出现概率P=90%的空间圈出来
②s电子、p电子的电子云轮廓图
s电子的电子云轮廓图:所有原子的任一能层的s电子的电子云轮廓图都是球形,只是球的半径不同。
同一原子的能层越高,s电子云的半径越大,如下图所示。这是由于1s、2s、3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。

图:同一原子的s电子的电子云轮廓图
p电子的电子云轮廓图:p电子云轮廓图是哑铃状的。每个p能级都有3个相互垂直的电子云,分别称为px、py,和pz,右下标x、y、z分别是p电子云在直角坐标系里的取向,如图所示。p电子云轮廓图的平均半径随能层序数的增大而增大。
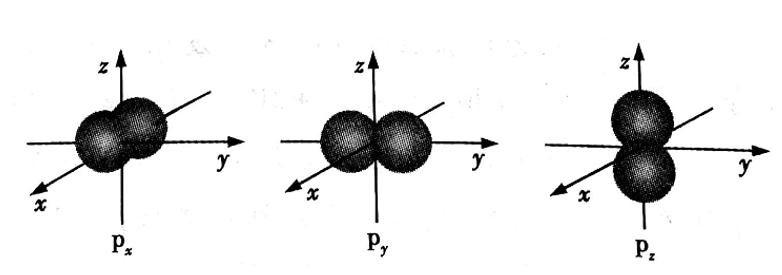
图:px、py、pz的电子云轮廓图
2.原子轨道
(1)定义:量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道。
(2)不同能层的能级、原子轨道及电子云轮廓图
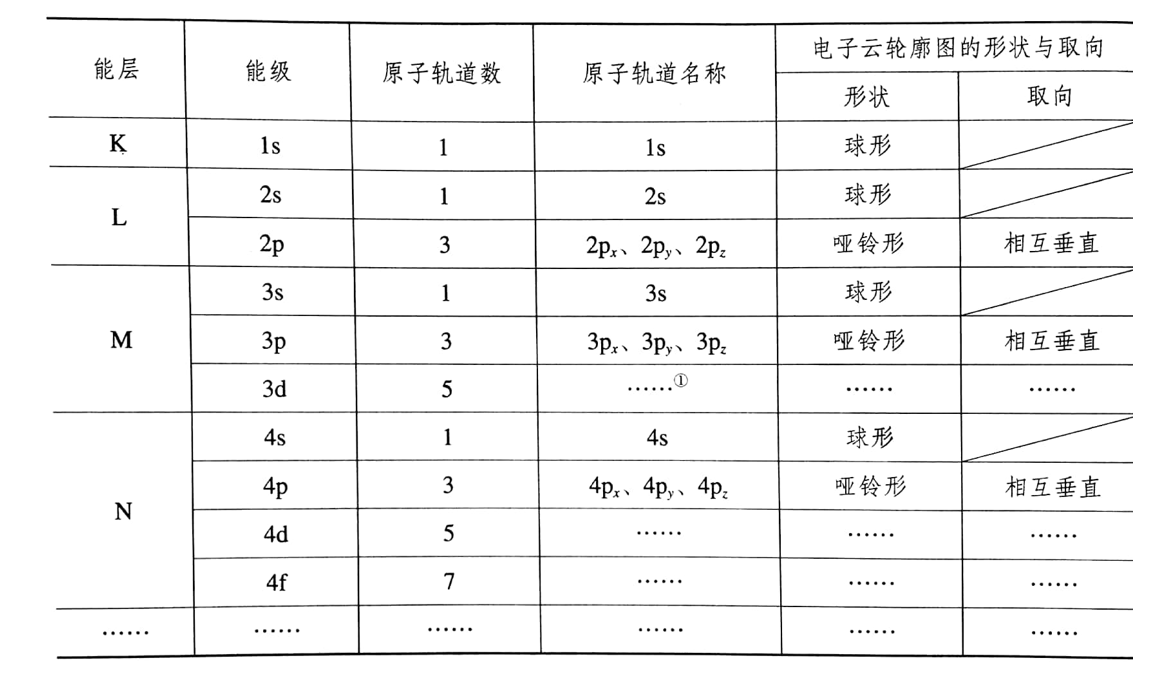
注:①同一能层中,不同能级原子轨道的能量及空间伸展方向不同;但同一能级的几个原子轨道的能量相同
②人们把同一能级的几个能量相同的原子轨道称为简并轨道。
(3)各能级所含原子轨道的数目