1、根据构造原理得出的核外电子排布与周期中元素种类数的关系:
(1)各周期总是从ns能级开始、以np结束(第一周期除外,第一周期从1s1开始,以1s2结束),中间按照构造原理依次排满各能级。而从ns能级开始以np结束递增的核电荷数(或电子数)就等于每个周期里的元素数,具体数据如下:

(2)能级组:能量相近的能级合并成一组,共七个能级组,也就形成了7个周期,特点:能级组之间能量相差较大,能级组之内能量相差很小。
2、原子核外电子排布与族的关系

小结:对于主族和0族元素而言,价层电子数=ns能级上的电子数或ns+np能级上的电子总数
对于副族(镧系和锕系除外)和第VIII族而言,价层电子数=(n-1)d+ns能级上的电子总数
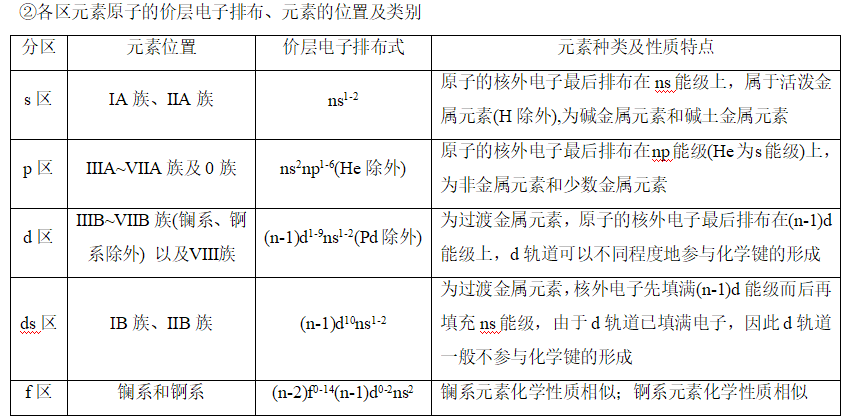
3、元素周期表的分区
(1)按电子排布分区
①按核外电子排布式中最后填入电子的能级符号可将元素周期表(第IB族、第ⅡB族除外)分为s、p、d、f 4个区,而第IB族、第ⅡB族的元素原子的核外电子因先填满了(n-1)d能级而后填充ns能级而得名ds区。这5个区的位置关系如图所示。

(2)按金属元素与非金属元素分区
①金属元素、非金属元素在元素周期表中的位置
沿着周期表中硼、硅、砷、碲、砹、与铝、锗、锑、钋、之间画一条线,线的左边是金属元素(氢除外),线的右边是非金属元素。非金属元素要集中在元素周期表右上角的三角区内(如图)。
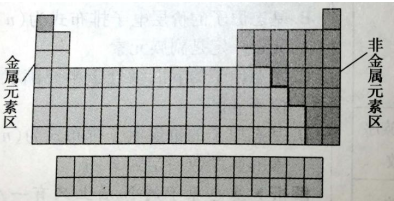
②金属与非金属交界处元素的性质特点:在元素周期表中位于金属和非金属分界线上的元素兼有金属和非金属的性质,位于此处的元素(如硼、硅、锗、砷、锑等)常被称为半金属或类金属(一般可用作半导体材料) 。