

1.概念
在相同条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应称为可逆反应 

2.表示方法

可逆反应方程式常用“ ”连接,把从左向右进行的反应称为正反应,把从右向左进行的反应称为逆反应
”连接,把从左向右进行的反应称为正反应,把从右向左进行的反应称为逆反应 。例如:SO2与H2O反应可表示为SO2+H2O
。例如:SO2与H2O反应可表示为SO2+H2O H2SO3。
H2SO3。
3.特点

(1)双向性:可逆反应分为方向相反的两个反应——正反应和逆反应

(2)双同性:同一条件下,正反应和逆反应同时发生、同时存在

(3)共存性:反应不能进行到底,反应物和生成物共存于同一体系中,反应物的转化率小于100%。

(4)能量转化类型相反:若正反应放热,则逆反应吸热


1.化学平衡的建立
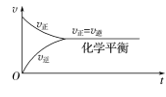
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。反应过程如下:
——正反应速率最大,逆反应速率为零;
——反应物浓度逐渐减小→v正逐渐减小;生成物浓度由零逐渐增大→v逆从零开始逐渐增大;
——v正=v逆,反应混合物中各组分的浓度保持不变。
以上过程可用下图表示:
2.化学平衡状态
一定条件下,可逆反应中,正反应速率与逆反应速率相等,反应混合物中各种物质的浓度或质量保持不变的状态。
3.化学平衡状态的特征
化学平衡状态具有“逆”“等”“动”“定”“变”的特征。
(1)逆:化学平衡研究的对象是可逆反应。
(2)等:正反应速率和逆反应速率相等。
(3)动:化学平衡从表面上或宏观上看好像停止了,但从本质上看反应并未停止,只不过正反应速率与逆反应速率相等罢了。
(4)定:在平衡混合物中,各组成成分的百分含量保持一定,不再随时间的改变而改变。
(5)变:化学平衡是在一定条件下建立的暂时平衡,若影响化学平衡的外界条件改变,化学平衡状态就会发生改变。
03化学平衡状态的判断
1.用本质特征判断
判断依据:正反应速率与逆反应速率相等,即v正=v逆。
(1)同一种物质:该物质的生成速率等于它的消耗速率。
(2)不同的物质:速率之比等于化学方程式中各物质的化学计量数之比,但必须是不同方向的速率。
2.用宏观特征判断
判断依据:反应混合物中各组成成分的浓度、含量保持不变。
(1)各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
(2)各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
(3)反应物的转化率、产物的产率保持不变。