















化学平衡常数
1.概念
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,即化学平衡常数,用符号K表示。
2.化学平衡常数的表达式
当mA(g)+nB(g)pC(g)+qD(g)在一定温度下达到化学平衡时,K=B(D)。
3.化学平衡常数的意义
平衡常数的大小反映了化学反应进行的程度(也叫反应的限度)。
①K值越大,表示反应进行得越完全,反应物的转化率越大。
②当K>105时,该反应就进行的基本完全了。K值越小,表示反应进行得越不完全,反应物的转化率越小。当K<10-5时,该反应很难发生。
③判断反应的ΔH:若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。
4.影响因素
内因:不同的化学反应及方程式的书写形式是决定化学平衡常数的主要因素。
外因:在化学方程式一定的情况下,K只受温度影响,与反应物或生成物的浓度变化无关,与压强变化、是否使用催化剂无关。
5.浓度商
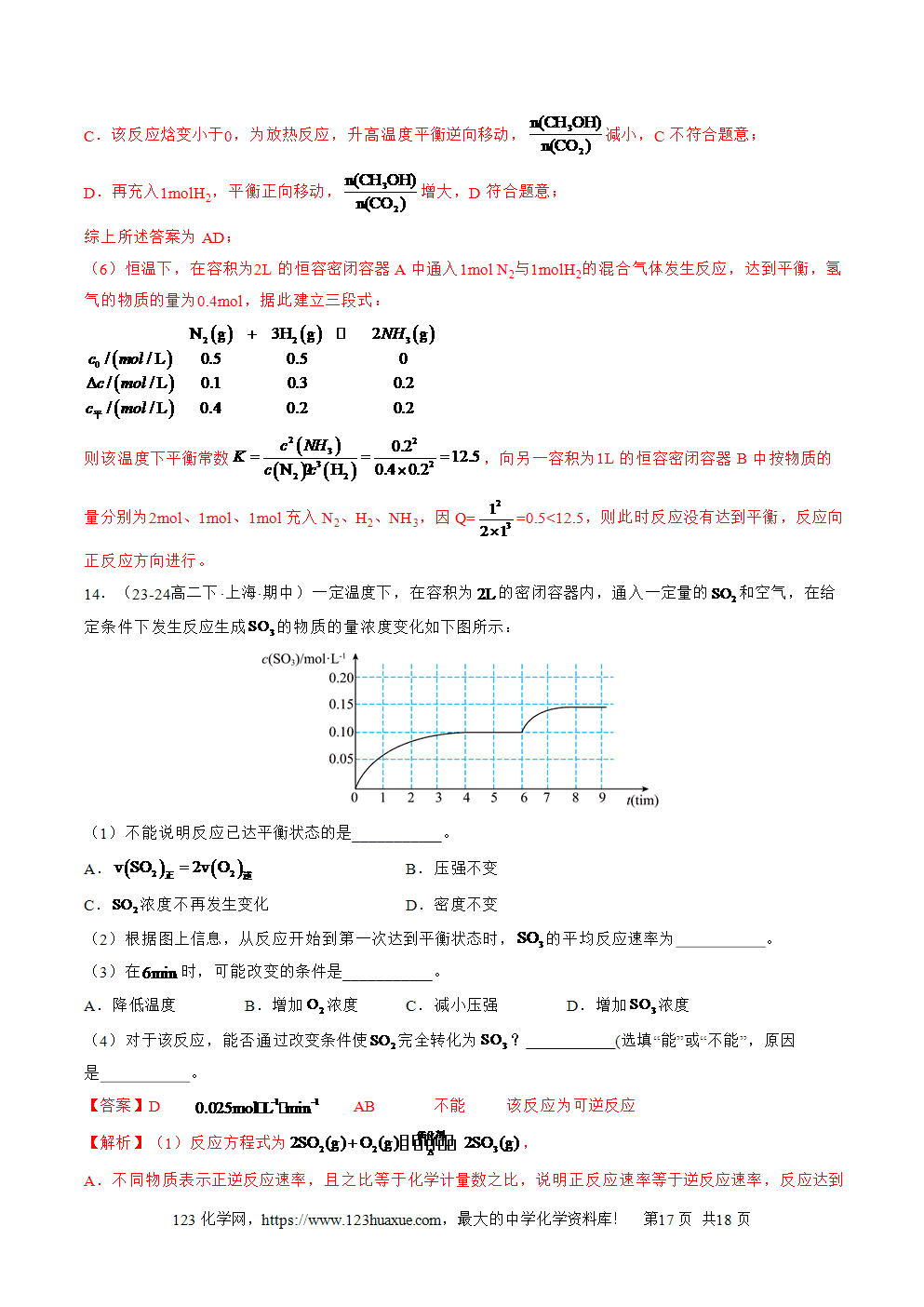
对于一般的可逆反应,mA(g)+nB(g)pC(g)+qD(g),在任意时刻的B(D)称为浓度商,常用Qc表示,即Qc=B(D)。根据K与Qc判断判断正在进行的可逆是否平衡及反应向何方向进行:
①Qc<K,反应向正反应方向进行
②Qc=K,反应处于平衡状态
③Qc>K,反应向逆反应方向进行
1.平衡常数K的书写
①固体或纯液体和液态水不列入平衡常数的表达式中(注意有机反应中的H2O则应写入)。
②平衡常数的表达式与化学方程式的书写方式有关,如N2+3H22NH3,K=a,则有:
2NH3N2+3H2,K′=a(1);2(1)N2+2(3)H2NH3,K″=。
③对于给定的化学方程式,正逆反应的平衡常数互为倒数。
2.K值的大小只能预示着某种可逆反应向某方向进行的最大程度,但不能预示反应达到平衡所需时间。