








第一节 铁及其化合物
第1课时 铁的单质、氧化物和氢氧化物
[核心素养发展目标] 1.结合生活中铁制品的应用,了解单质铁、铁的氧化物的性质及用途,培养化学服务社会的责任意识。2.通过探究实验,认识铁单质与水蒸气反应的条件,对比钠与水的反应,加深对微观原子结构决定物质宏观性质的认识,培养宏观辨识与微观探析的能力。3.通过实验掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
一、铁的单质
1.铁的存在和冶炼
(1)存在
(2)含量
铁元素在地壳中的含量居第四位,仅次于氧、硅和铝。
(3)冶炼
工业炼铁的原理是用还原的方法把铁从铁矿石中提炼出来,化学方程式(以Fe2O3为例):3CO+Fe2O32Fe+3CO2。
2.铁的物理性质
银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁体吸引。
3.铁的化学性质
(1)与某些非金属单质、非氧化性酸和盐溶液反应。
写出下列有关反应的化学方程式,是离子反应的写离子方程式。
①Fe与非金属单质反应
②Fe与非氧化性酸反应(如盐酸)
Fe+2H+===Fe2++H2↑。
③Fe与盐溶液反应(如CuSO4溶液)
Fe+Cu2+===Cu+Fe2+。
思考1 上述反应中,铁的化合价的变化有何异同?为什么会有这样的异同?
提示 在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。铁与弱氧化剂(如盐酸、CuSO4等)反应,生成+2价铁的化合物,而与强氧化剂(如Cl2等)反应,生成+3价铁的化合物。
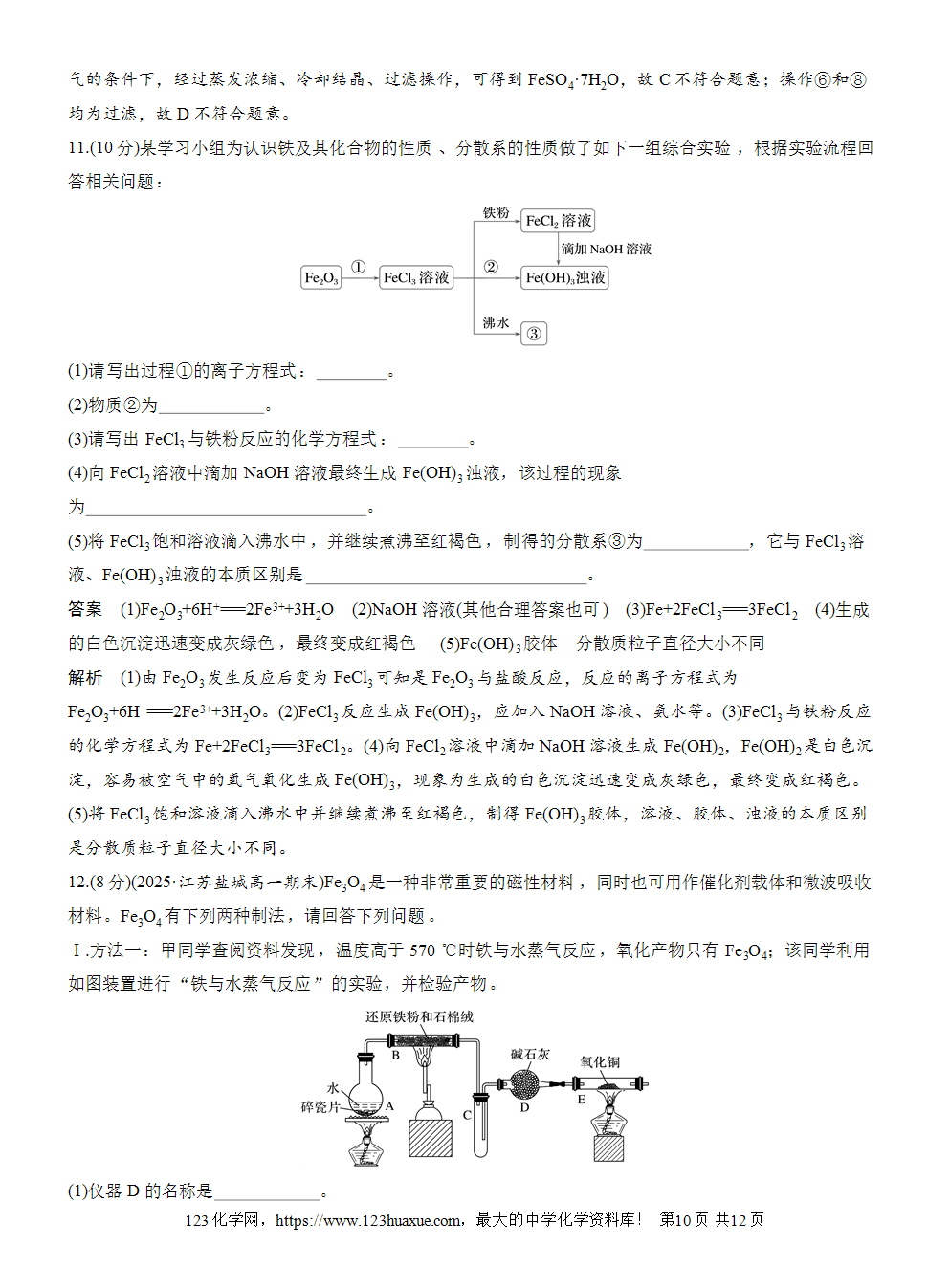
(2)实验探究铁粉与水蒸气的反应。
思考2 在钢铁厂的生产中,炽热的铁水注入模具之前,模具为什么必须进行充分的干燥处理?
提示 在高温下,铁能与水发生反应。
用燃着的火柴去点肥皂泡,观察到的现象是肥皂泡燃烧,听到爆鸣声,证明生成了H2,则该反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。上述实验装置中,湿棉花的作用是受热时提供反应所需的水蒸气。
铁在氧气中燃烧或与水蒸气反应生成既有+2价又有+3价铁元素的氧化物Fe3O4。
1.判断正误
(1)由于铁单质性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)铁与AgNO3、ZnCl2等盐溶液均能发生反应生成Fe2+( )
(3)分离铁粉与铜粉的混合物时,只能用化学方法( )
(4)1 mol Fe与水蒸气在高温下反应转移 mol e-( )
答案 (1)× (2)× (3)× (4)√