








第2课时 氯气的实验室制法 氯离子的检验
[核心素养发展目标] 1.通过实验室制氯气的实验操作,培养实验能力与创新意识,构建气体制备思维模型。2.通过氯离子的检验方法,构建离子检验的思维模型。
一、氯气的实验室制法
1.实验原理
在实验室中,通常用浓盐酸和二氧化锰在加热的条件下反应来制取氯气。
化学方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,离子方程式:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,该反应的氧化剂为MnO2,浓盐酸既表现还原性,又表现酸性。
思考1 (1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。反应中氧化剂和还原剂的个数之比是多少?
提示 由氧化产物和还原产物的个数可知,氧化剂和还原剂的个数之比是1∶2。
(2)含有146 g HCl的浓盐酸与足量的MnO2反应,能生成71 g Cl2吗?
提示 不能。有两个原因:一是随着反应的进行,盐酸浓度变小,Cl-的还原性减弱,MnO2不能再氧化HCl,此反应不再进行;二是浓盐酸的挥发。
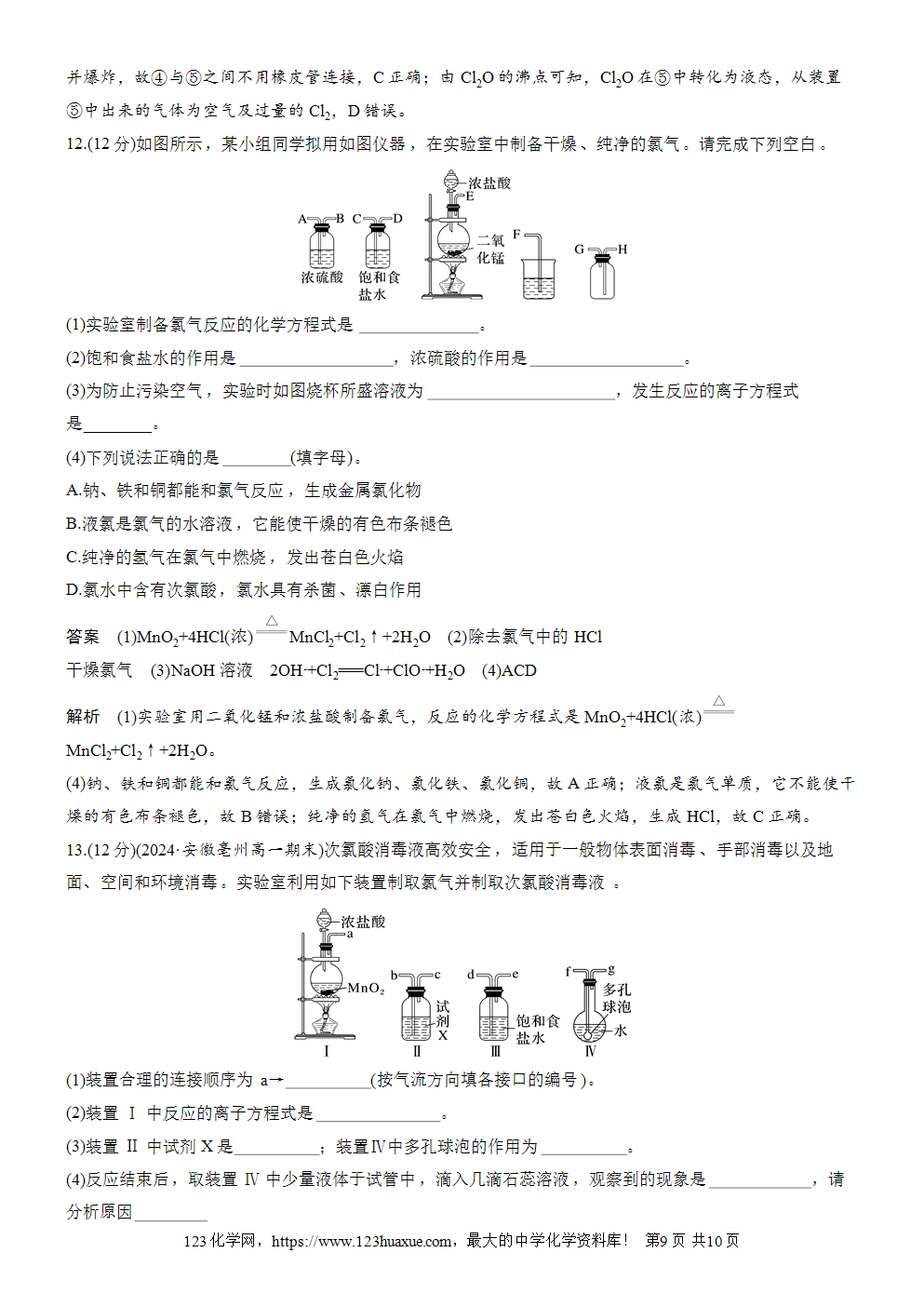
2.仪器装置
主要仪器有铁架台、酒精灯、圆底烧瓶、分液漏斗、洗气瓶、集气瓶、烧杯等。
Cl2的制备、净化、收集、尾气处理装置如图所示。