








第4课时 配制一定物质的量浓度的溶液
[核心素养发展目标] 1.了解容量瓶的特点、用途及使用注意事项。2.掌握配制一定物质的量浓度的溶液的方法及操作,建立实验误差分析思维模型,并能应用模型解决实际问题。
一、一定物质的量浓度溶液的配制
1.主要仪器
托盘天平(或分析天平)、烧杯、玻璃棒、容量瓶、胶头滴管、量筒。
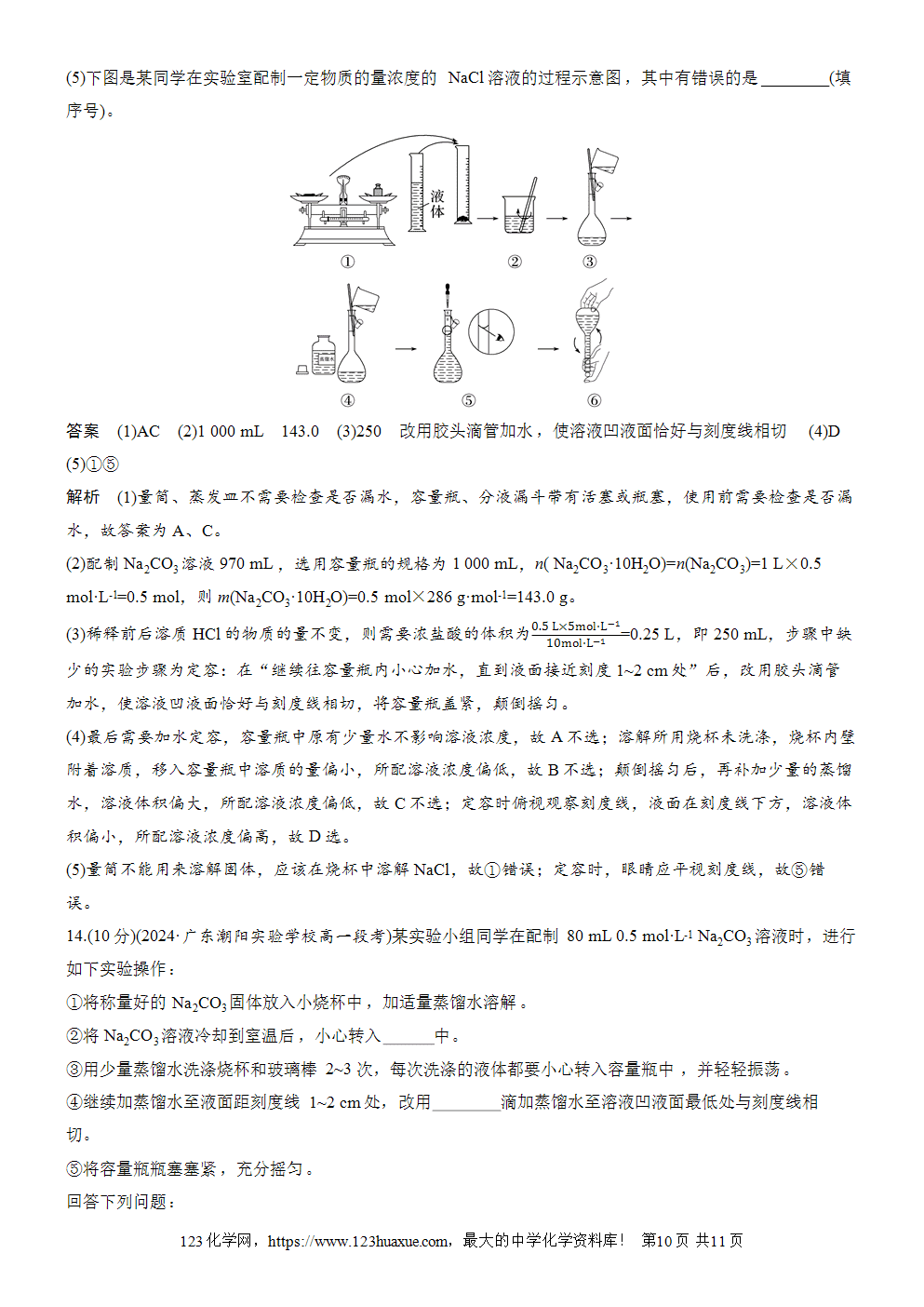
2.容量瓶
思考1 容量瓶使用前需要检验是否漏水吗,应该如何操作?
提示 使用前要检验容量瓶是否漏水。检验程序:加水→塞瓶塞→倒立→查漏→正立→瓶塞旋转180°→倒立→查漏。
3.配制过程
以配制100 mL 1.00 mol·L-1 氯化钠溶液为例
思考2 实验室需要配制480 mL 1.00 mol·L-1的氢氧化钠溶液,则用托盘天平称量多少克氢氧化钠固体?
提示 配制氢氧化钠溶液480 mL,需要容量瓶的容积为500 mL。则计算应按照500 mL (0.5 L)计算。则n=c·V=1.00 mol·L-1×0.5 L=0.5 mol,m=n·M=0.5 mol×40 g·mol-1=20 g。托盘天平的精确度为0.1 g,则用托盘天平称量20.0 g氢氧化钠固体。
思考3 现用98%的浓H2SO4(ρ=1.84 g·cm-3)配制浓度为0.5 mol·L-1的稀硫酸500 mL。
(1)配制该溶液的步骤应该为计算、 、 、 、移液、洗涤、定容、摇匀、装瓶。
答案 量取 稀释 冷却
(2)配制该溶液应选用的玻璃仪器有烧杯、玻璃棒、 、胶头滴管和 。
答案 量筒 500 mL容量瓶
(3)所需浓H2SO4的体积为 mL。
答案 13.6
解析 (3)根据稀释前后硫酸物质的量不变,稀释前c(H2SO4)= mol·L-1=18.4 mol-1,所需浓H2SO4的体积为≈13.6 mL。
1.判断正误
(1)配制溶液时,可以用托盘天平称取10.0 g固体溶质( )
(2)要配制230 mL溶液,必须选择250 mL容量瓶( )
(3)配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸( )
(4)在使用容量瓶配制NaOH溶液或稀H2SO4时,必须要等溶液恢复至室温再转移到容量瓶中( )
(5)配制好的溶液保存在容量瓶中备用( )
答案 (1)√ (2)√ (3)× (4)√ (5)×