













2024年普通高等学校招生全国统一考试·全国甲卷
限时50分钟 满分100分
11、12题题型新高考已取消
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Zn—65 Pb—207
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2024·全国甲卷,7)人类对能源的利用经历了柴薪、煤炭和石油时期,现正向新能源方向高质量发展。下列有关能源的叙述错误的是( )
A.木材与煤均含有碳元素
B.石油裂化可生产汽油
C.燃料电池将热能转化为电能
D.太阳能光解水可制氢
解析:C 燃料电池将化学能转化为电能,C错误。
2.(2024·全国甲卷,8)下列过程对应的离子方程式正确的是( )
A.用氢氟酸刻蚀玻璃:SiO3(2-)+4F-+6H+===SiF4↑+3H2O
B.用三氯化铁溶液刻制覆铜电路板:2Fe3++3Cu===3Cu2++2Fe
C.用硫代硫酸钠溶液脱氯:S2O3(2-)+2Cl2+3H2O===2SO3(2-)+4Cl-+6H+
D.用碳酸钠溶液浸泡锅炉水垢中的硫酸钙:CaSO4+CO3(2-)===CaCO3+SO4(2-)
解析:D 玻璃的主要成分是SiO2,且氢氟酸是弱酸,在书写离子方程式时不能拆分,A错误;Fe的还原性大于Cu,Cu不能置换出Fe,三氯化铁与铜反应生成Fe2+和Cu2+,B错误;硫代硫酸根离子可被氯气氧化为硫酸根离子,故正确的离子方程式为 S2O3(2-)+4Cl2+5H2O===2SO4(2-)+8Cl-+10H+,C错误。
3.(2024·全国甲卷,9)我国化学工作者开发了一种回收利用聚乳酸(PLA)高分子材料的方法,其转化路线如图所示。
下列叙述错误的是( )
A.PLA在碱性条件下可发生降解反应
B.MP的化学名称是丙酸甲酯
C.MP的同分异构体中含羧基的有3种
D.MMA可加聚生成高分子
解析:C PLA属于聚酯类,故碱性条件下可被降解,A正确;MP由丙酸与甲醇发生酯化反应生成,故按酯类命名规则,其名称为丙酸甲酯,B正确;MP的分子式为C4H8O2,其同分异构体中含羧基的有2种,分别为,C错误;MMA中C===C键能发生加聚反应,故可生成,D正确。
4.(2024·全国甲卷,10)四瓶无色溶液NH4NO3、Na2CO3、Ba(OH)2、AlCl3,它们之间的反应关系如图所示。其中a、b、c、d代表四种溶液,e和g为无色气体,f为白色沉淀。下列叙述正确的是( )
A.a呈弱碱性
B.f可溶于过量的b中
C.c中通入过量的e可得到无色溶液
D.b和d反应生成的沉淀不溶于稀硝酸
解析:B a和b在加热条件下仅生成无色气体e,故a和b的反应为NH4NO3和Ba(OH)2在加热条件下生成氨气的反应,b既可与a反应生成NH3,又可和c反应生成白色沉淀,故b为Ba(OH)2,a为NH4NO3,则c为Na2CO3或AlCl3;b和c、c和d反应均可生成白色沉淀f,则白色沉淀f为Al(OH)3,c为AlCl3、d为Na2CO3、g为CO2。
由分析知,a为NH4NO3,NH4(+)水解使溶液呈酸性,A错误;Al(OH)3可与强碱反应生成四羟基合铝酸根离子,故可溶于过量的Ba(OH)2中,B正确;AlCl3与过量的NH3反应生成Al(OH)3白色沉淀,C错误;Ba(OH)2和Na2CO3反应生成BaCO3沉淀,BaCO3可以溶于稀硝酸生成二氧化碳和Ba(NO3)2,D错误。
5.(2024·全国甲卷,11)W、X、Y、Z为原子序数依次增大的短周期元素。W和X原子序数之和等于Y-的核外电子数,化合物W+[ZY6] -可用作化学电源的电解质。下列叙述正确的是( )
A.X和Z属于同一主族
B.非金属性:X>Y>Z
C.气态氢化物的稳定性:Z>Y
D.原子半径:Y>X>W
解析:A 化合物W+[ZY6]-可用作化学电源的电解质,结合Y可形成Y-知,该化合物中W为+1价,Z为+5价,Y为-1价,则W位于第ⅠA族,Y为F或Cl,又W、X、Y、Z为原子序数依次增大的短周期元素,故Y只能为F,则W为Li、Z为P,该化合物为Li[PF6];根据W和X原子序数之和等于Y-的核外电子数知,X为N。
N和P均位于第ⅤA族,A正确;同周期元素从左到右,元素的非金属性逐渐增强,同主族元素从上到下,元素的非金属性逐渐减弱,故非金属性:F>N>P,B错误;元素的非金属性越强,对应的简单气态氢化物越稳定,非金属性:F>P,故稳定性:HF>PH3,C错误;同周期主族元素从左到右,原子半径逐渐减小,故原子半径:Li>N>F,D错误。
6.(2024·全国甲卷,12)科学家使用δMnO2研制了一种MnO2Zn可充电电池(如图所示)。电池工作一段时间后,MnO2电极上检测到MnOOH和少量ZnMn2O4。下列叙述正确的是( )
A.充电时,Zn2+向阳极方向迁移
B.充电时,会发生反应Zn+2MnO2===ZnMn2O4
C.放电时,正极反应有MnO2+H2O+e-===MnOOH+OH-
D.放电时,Zn电极质量减少0.65 g,MnO2电极生成了0.020 mol MnOOH
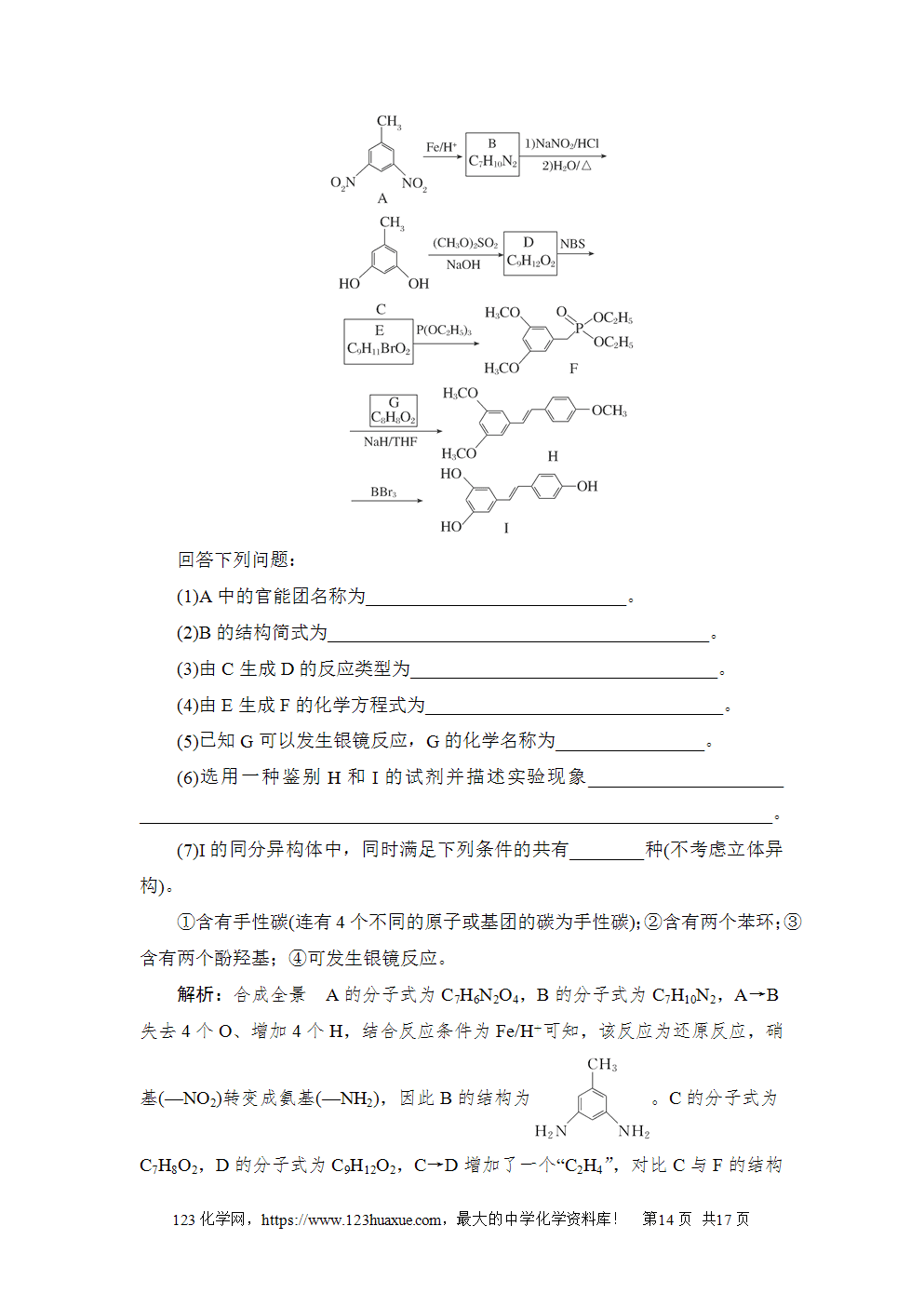
解析:C 充电时Zn2+向阴极移动,A错误;由题意知,放电时,MnO2转化为MnOOH和ZnMn2O4,B错误;放电时,MnO2电极为正极,发生的反应有MnO2+H2O+e-===MnOOH+OH-,C正确;根据放电时Zn电极的电极反应式为Zn-2e-===Zn2+可知,Zn电极质量减少0.65 g(0.01 mol)时,电路中通过0.02 mol电子,故MnO2电极有0.02 mol MnO2发生反应,但MnO2转化为MnOOH和少量ZnMn2O4,故生成的MnOOH的量小于0.020 mol,D错误。