
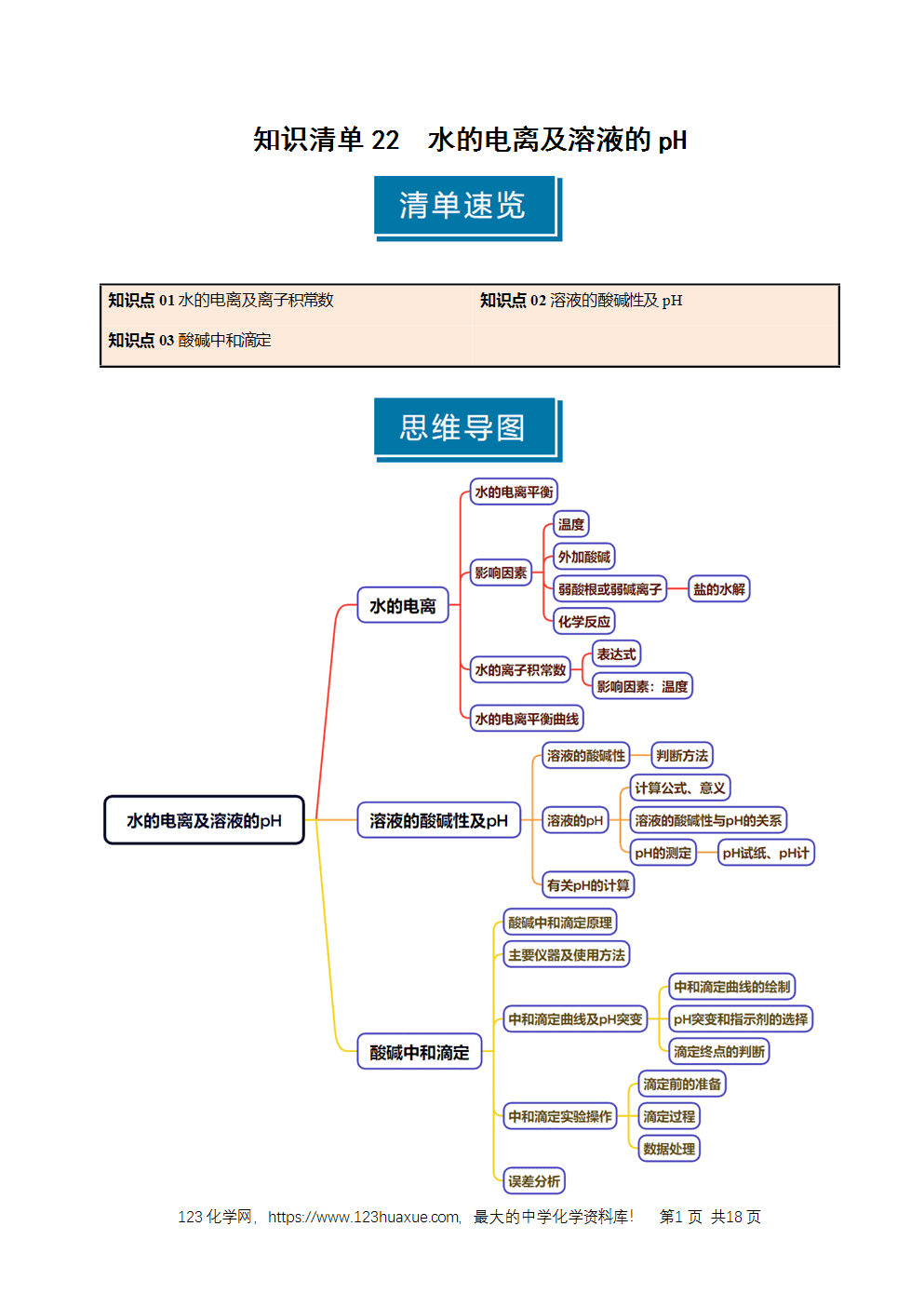
















1.水的电离
(1)水是极弱的电解质,其电离方程式为H2O+H2OH3O++OH-,简写为H2OH++OH-。
(2)水的电离是吸热过程。
2.水的离子积常数
(1)Kw只与温度有关,温度升高,Kw增大。
(2)常温时,Kw=c(H+)·c(OH-)=1.0×10-14,不仅适用于纯水,还适用于酸、碱的稀溶液。
(3)不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由水电离出的c(H+)与c(OH-)总是相等的。
3.水的电离平衡的影响因素
(1)因水的电离是吸热过程,故温度升高,会促进水的电离,c(H+)、c(OH-)都增大,水仍呈中性。
(2)外加酸(或碱),水中c(H+)[或c(OH-)]增大,会抑制水的电离,水的电离程度减小,Kw不变。
(3)加入了活泼金属,可与水电离产生的H+直接发生置换反应,产生H2,使水的电离平衡向右移动。