





第1讲 反应热 焓变
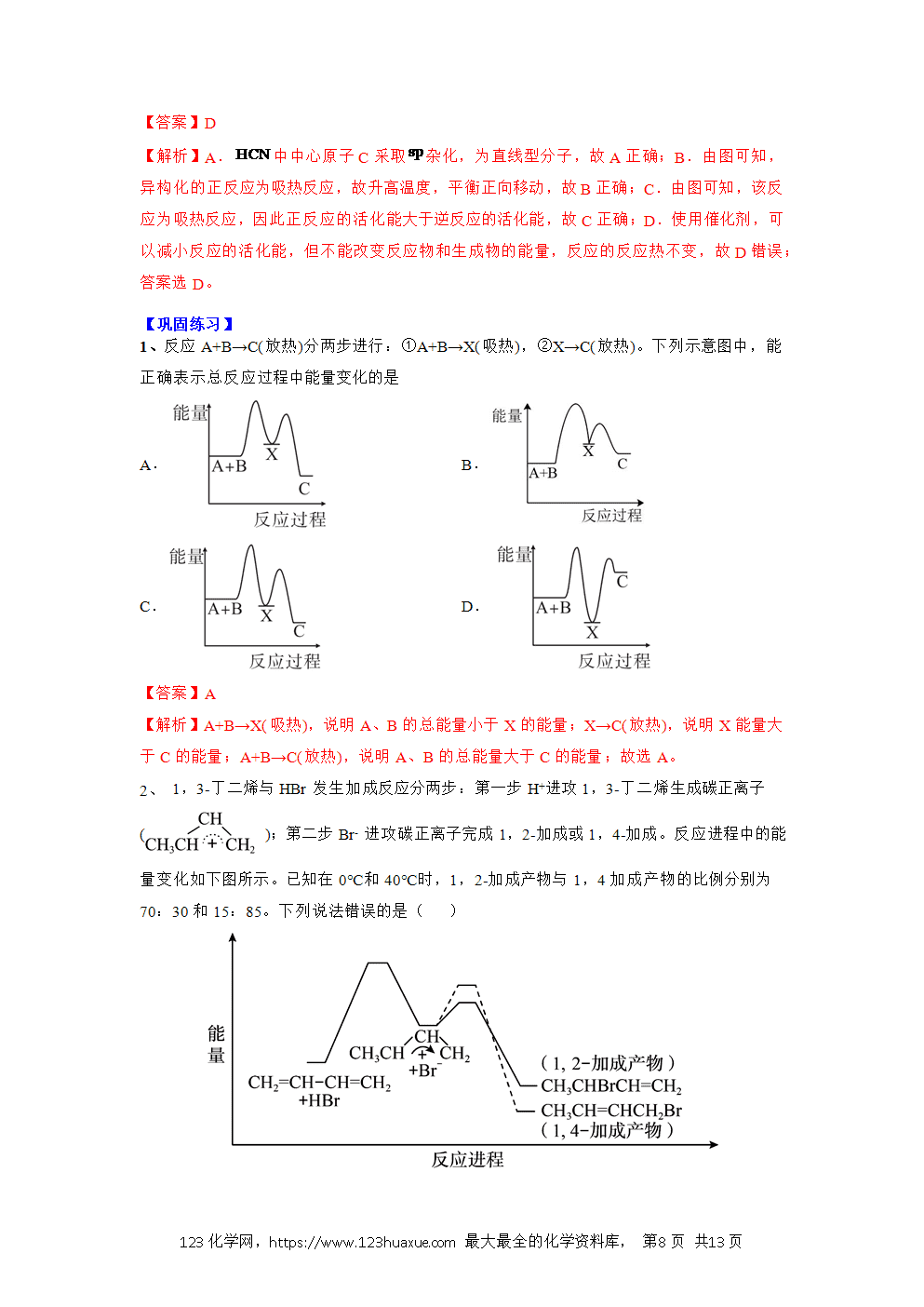
【学习目标】
1、理解反应热的概念
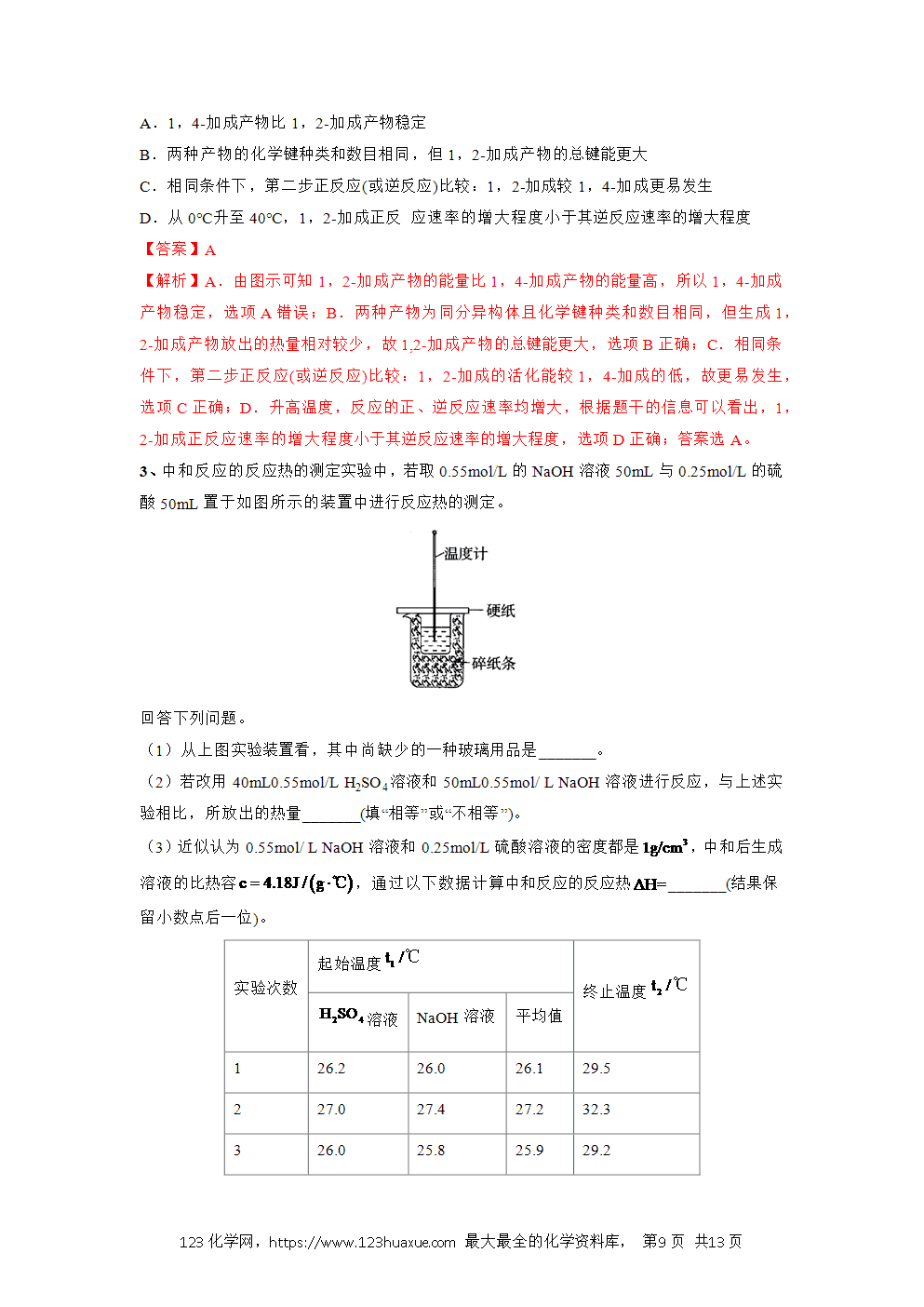
2、 能以中和热的测定为例掌握反应热的测定方法;
3、能从宏观和微观两个角度解释反应热产生的原因及掌握反应热的计算方法。
【学习重难点】
重点:反应热、焓变的含义;中和热的测定
难点:焓变、ΔH的“+”与“-”的理解与应用、中和热的测定
【自主预习】
1.体系与环境
被研究的 物质系统 称为体系,与体系相互影响的其他部分称为 环境 。
热量是指因 温度 不同而在体系与环境之间交换或传递的 能量 。
【举例】将试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系;盛溶液的试管和溶液之外的空气等看作环境。
2.反应热
在 等温 条件下,化学反应体系向环境 释放 或从环境 吸收 的热量,称为化学反应的 热效应 ,简称反应热。
【合作探究】
一.实验探究:中和反应反应热的测定
(1)测定原理:环境温度 不变 时,根据测得的体系的温度变化和有关物质的 比热容 等来计算反应热。即利用公式 进行计算。
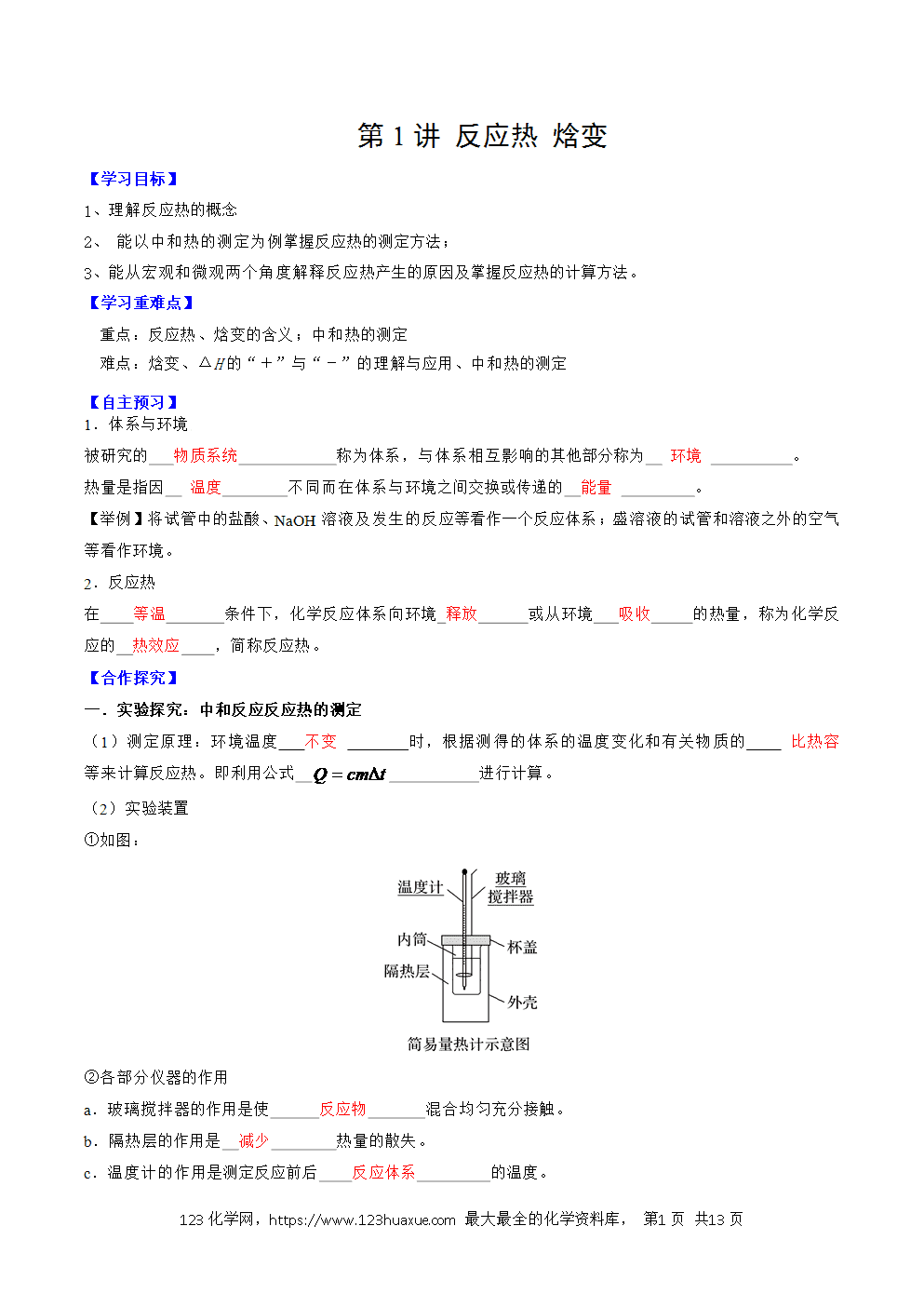
(2)实验装置
①如图:
②各部分仪器的作用
a.玻璃搅拌器的作用是使 反应物 混合均匀充分接触。
b.隔热层的作用是 减少 热量的散失。
c.温度计的作用是测定反应前后 反应体系 的温度。