
2025年秋季高中化学人教版选择性必修1《化学反应原理》03 课后素养评价(三)反应热的计算word版含答案




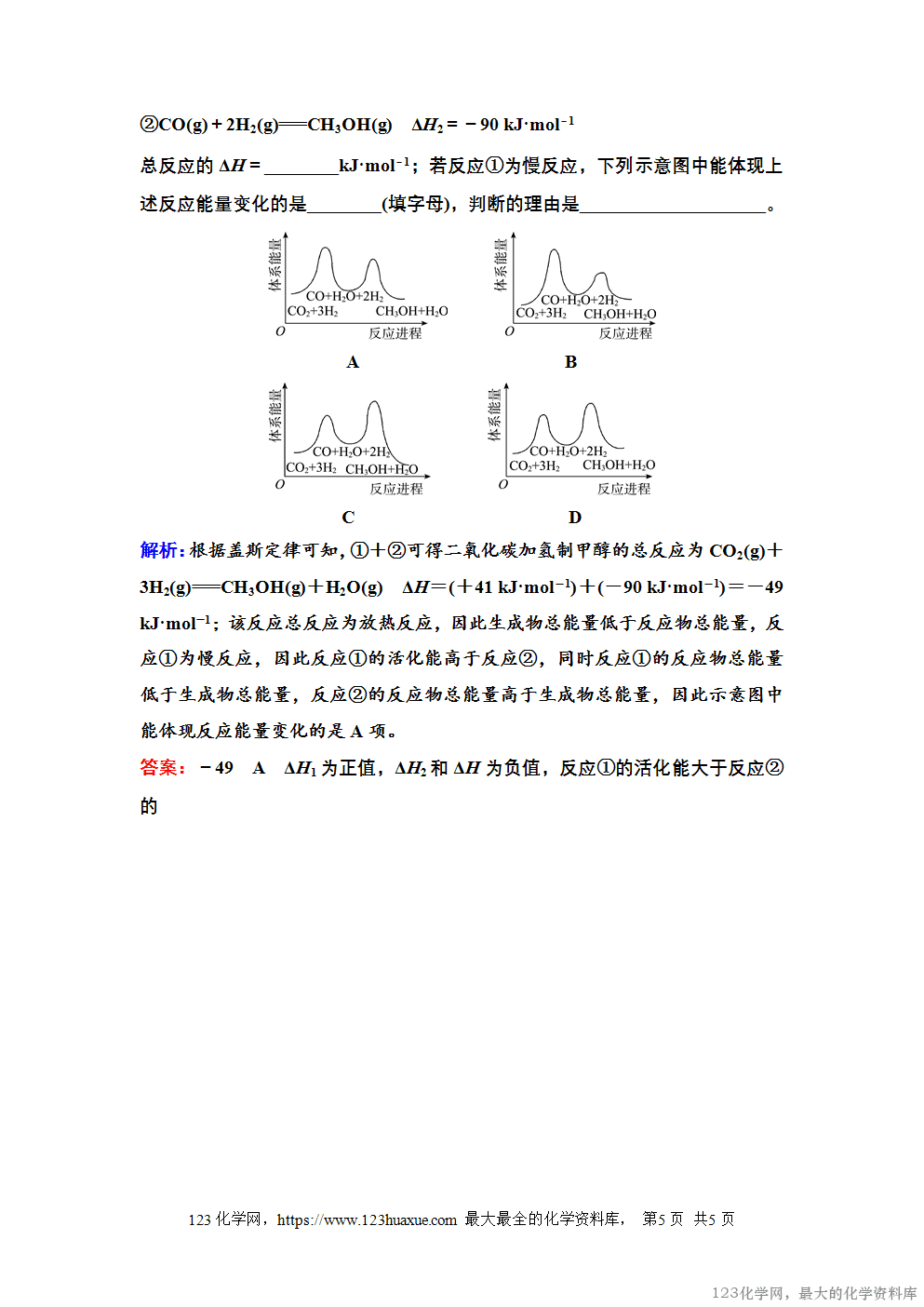
知识点1 盖斯定律
1.Li/Li2O体系的能量循环如图所示。下列说法正确的是( )
A.ΔH3<0
B.ΔH3+ΔH4+ΔH5=ΔH6
C.ΔH6>ΔH5
D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
C 解析:断裂化学键吸收能量,氧气断裂化学键变为氧原子过程中吸热,ΔH3>0,A错误;由盖斯定律可知:反应一步完成与分步完成的热效应相同,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6,B、D错误,C正确。
2.钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为
TiO2―→TiCl4Ti
已知:①C(s)+O2(g)===CO2(g) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为( )
A.ΔH3+2ΔH1+2ΔH2
B.ΔH3+2ΔH1+ΔH2
C.ΔH3+2ΔH1-ΔH2
D.ΔH3+2ΔH1-2ΔH2
C 解析:由③+①×2-②可得,TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g) ΔH=ΔH3+2ΔH1-ΔH2。
3.Mn2+催化H2O2分解:2H2O2(l)===2H2O(l)+O2(g) ΔH1,其反应机理如下图所示。
若反应Ⅱ的焓变为ΔH2,则反应Ⅰ的焓变ΔH为(反应Ⅰ、Ⅱ的化学计量数均为最简整数比)( )
A.ΔH1-ΔH2 B.ΔH1+ΔH2
C.2ΔH1-ΔH2 D.ΔH1-2ΔH2
A 解析:由图可知反应过程为H2O2+Mn2+===2H++MnO2(Ⅰ)、MnO2+H2O2+2H+===Mn2++2H2O+O2↑(Ⅱ),题给反应可由两个反应相加获得,有ΔH1=ΔH+ΔH2,ΔH=ΔH1-ΔH2。
4.由金属Mg和O2生成MgO的相关反应及热效应(kJ·mol-1)如下图所示。由此可判断ΔH是( )
A.725 kJ·mol-1 B.-725 kJ·mol-1
C.1 929 kJ·mol-1 D.-1 929 kJ·mol-1
A 解析:根据盖斯定律可知:[141+2 201+247+ΔH+(-3 916)]kJ·mol-1=-602 kJ·mol-1,解得ΔH=725 kJ·mol-1。
知识点2 反应热的计算
5.常温下,0.01 mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。MOH在水溶液中电离的ΔH为( )
A.+33.1 kJ·mol-1 B.+45.2 kJ·mol-1