









第3讲 影响化学平衡的因素
1、理解化学平衡的基本概念和建立过程
2、了解化学反应的可逆性
3、掌握化学平衡状态的特征。
4、理解可逆反应的内涵和特点,判断可逆反应进行到平衡状态。
重点:化学平衡状态的概念和特征、可逆反应的特点
难点:可逆反应的理解、化学平衡状态的特征
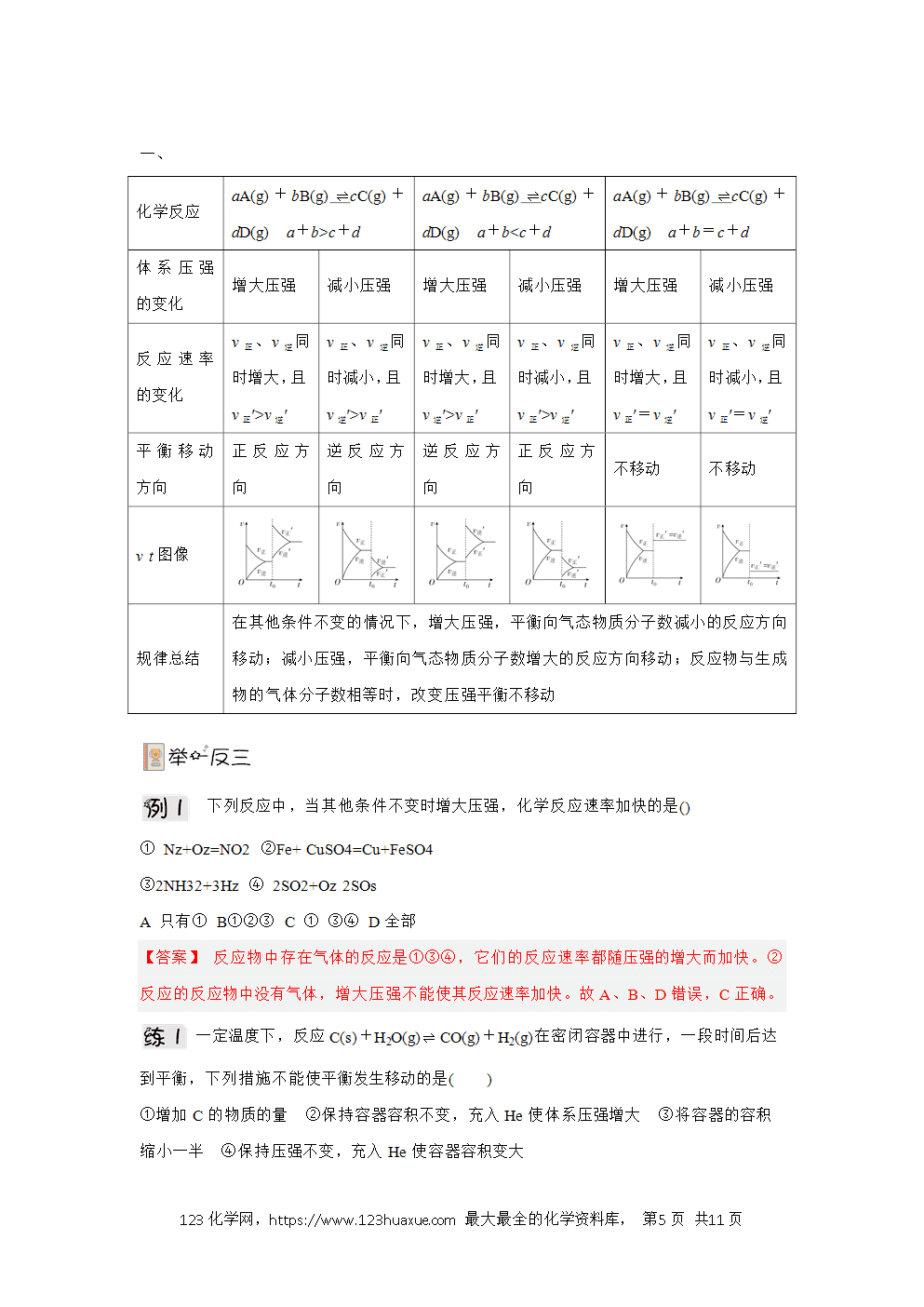
一、化学平衡移动与勒夏特列含义
1.定义: 化学平衡移动是指在一定条件下,一个可逆反应达到平衡状态 以后,如果反应条件如温度、压强,以及参加反应的化学物质的物质的量浓度改变了,原来的平衡就会被破坏, 平衡混合物里各组分的百分含量也随着改变,从而在新的条件下达到新的平衡,这叫做化学平衡移动。
2.勒夏特列原理
如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动,这就是勒夏特列原理,也称化学平衡移动原理。
二、平衡移动方向的判据
⒈ 在等温下,对于一个可逆反应正逆反应速率的大小关系可以判断化学平衡的移动方向。
①当V正=V逆,已达平衡态,平衡不再移动。
②当V正>V逆,为了达到平衡,需要V正减小,V逆增大,称为平衡正移/平衡右移。
③当V正<V逆,为了达到平衡,需要V逆减小,V正增大,称为平衡逆移/平衡左移
⒉在等温下,对于一个可逆反应,根据浓度商与平衡常数的大小关系可判断化学平衡的移动方向。
①当Q=K时,可逆反应处于平衡状态。
②当Q<K时,化学平衡向正反应方向移动,直至达到新的平衡状态。
③当Q>K时,化学平衡向逆反应方向移动,直至达到新的平衡状态。
⒊对于有气体参加的可逆反应,当达到平衡时,在其他条件不变的情况下,增大压强(减小容器的容积),会使化学平衡向气体体积缩小的方向移动;减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
4、反应前后气体的总体积没有变化的可逆反应,增大或减小压强都不能使化学平衡发生移动。固体或液态物质的体积受压强的影响很小,可以忽略不计。因此,当平衡混合物中都是固态或液态物质时,改变压强化学平衡一般不发生移动。