


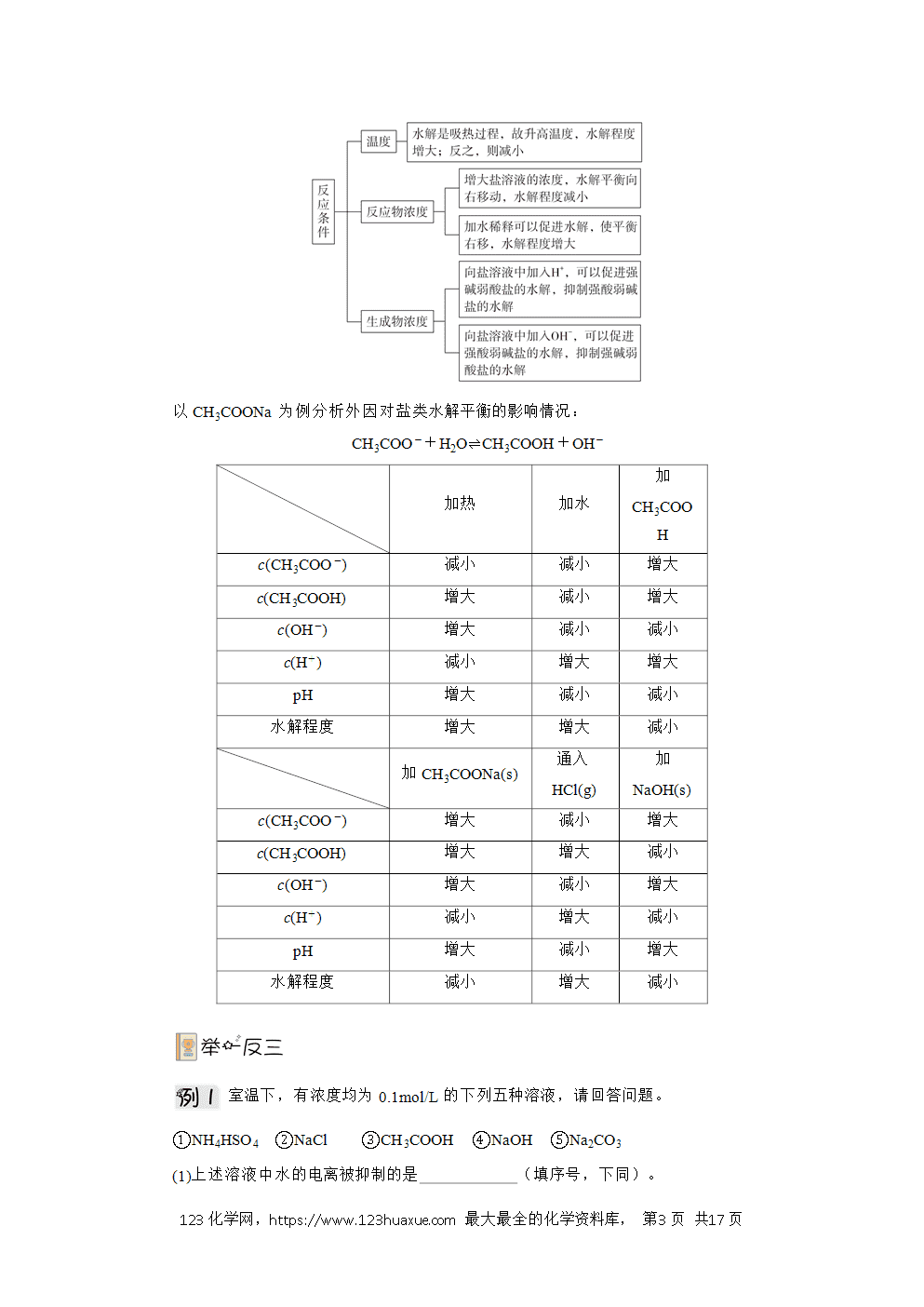









一 、影响盐类水解的因素
研究盐类水解时,一般从两个方面来探究:一是反应物的性质,二是反应条件。
(1)内因
盐的性质是影响盐类水解的主要因素。组成盐的酸根离子对应的弱酸酸性越弱(或阳离子对应的弱碱碱性越弱),盐的水解程度就越大。
(2)外因
①温度:盐类的水解可看作酸碱中和反应的逆反应,中和反应是放热反应,盐类的水解是吸热反应,因此加热可促使平衡向水解反应的方向移动,盐的水解程度增大。
②浓度:加水稀释可促使平衡向水解反应的方向移动,盐的水解程度增大。
③外加酸碱:在盐溶液中加入适量酸或碱,会引起盐类水解平衡的移动和水解程度的改变。
二、盐类水解的应用
(1)盐溶液的配制:配制FeCl3溶液时,可加入少量盐酸,目的是抑制FeCl3的水解。
(2)热碱去油污:用纯碱溶液清洗油污时,加热可增强去污效果,是由于CO2- 3水解:
CO2- 3+H2OHCO- 3+OH-,加热平衡正向移动,碱性增强。
(3)作净水剂:铝盐、铁盐等部分盐类水解生成的胶体有较强的吸附性,常用作净水剂。如明矾可以用来净水,其反应的离子方程式为Al3++3H2OAl(OH)3(胶体)+3H+。
(4)制备物质
用TiCl4制取TiO2发生反应的化学方程式为TiCl4+(x+2)H2O===TiO2·xH2O↓+4HCl、TiO2·xH2O△,TiO2+xH2O。
1.判断正误,正确的打“√”,错误的打“×”。
(1)用热的Na2CO3溶液清洗油污,效果更佳。( )
(2)实验室配制FeCl3溶液时,常将FeCl3晶体溶于稀硫酸中。( )
(3)铝盐、铁盐可用作净水剂,是因为Al3+、Fe3+水解生成的胶体具有杀菌作用。( )
(4)盐溶液浓度越大,Kw越大。( )
答案 (1)√ (2)× (3)× (4)×