









1.沉淀溶解平衡的应用
难溶电解质的沉淀溶解平衡是一种动态平衡,因此可以通过改变条件,控制其进行的方向,使沉淀转化为溶液中的离子,或者使溶液中的离子转化为沉淀。
(1)沉淀的生成
在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。如
①工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH,可使Fe3+生成Fe(OH)3沉淀而除去。发生的离子反应为Fe3++3NH3·H2O===Fe(OH)3↓+3NH4(+)。
②在工业废水处理过程中,以Na2S作沉淀剂,使某些金属离子如Cu2+、Hg2+等,生成极难溶的CuS、HgS沉淀而除去,也是分离、除去杂质常用的方法。发生的反应为Cu2++S2-===CuS↓,Hg2++S2-===HgS↓。
(2)沉淀的溶解
根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。如:
CaCO3难溶于水,却易溶于盐酸,原因是:CaCO3在水中存在的沉淀溶解平衡为CaCO3(s)Ca2+(aq)+CO2- 3(aq),当加入盐酸后发生反应:CO3(2-)+2H+===H2O+CO2↑,c(CO3(2-))减小,平衡向沉淀溶解的方向移动。
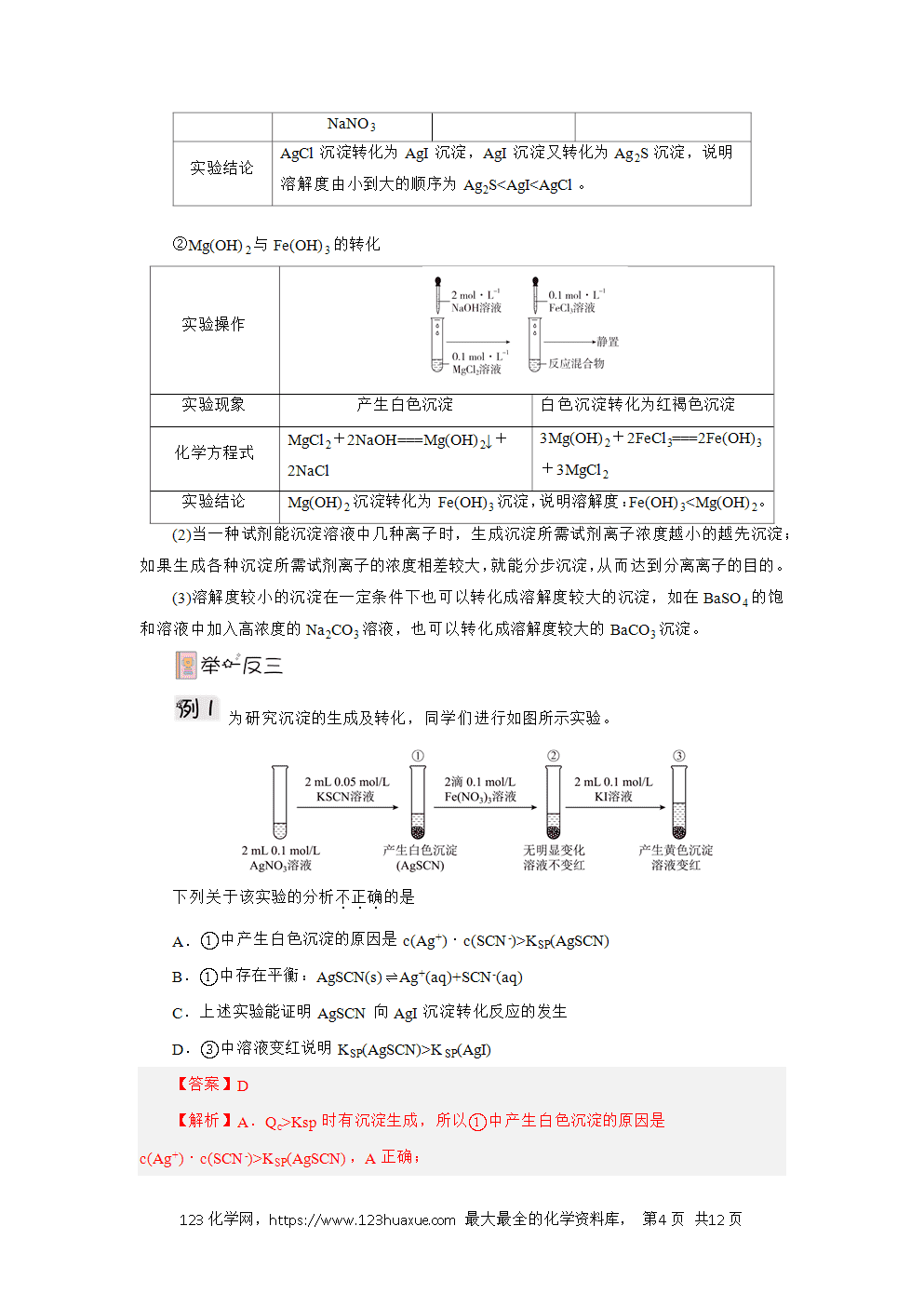
(3)沉淀的转化
①沉淀转化的实质与条件
a.实质:沉淀的转化是指由一种难溶物转化为另一种难溶物的过程,其实质是沉淀溶解平衡的移动。
b.条件:对于沉淀的转化,关键是满足一个条件,即两种沉淀的溶解度不同,一般来说,溶解度小的沉淀可以转化为溶解度更小的沉淀。
②沉淀转化的应用
a.锅炉除水垢(主要成分为CaSO4):
Na2CO3溶液,CaCO3(s)加酸(如盐酸),Ca2+(aq),反应为CaSO4+Na2CO3===CaCO3+Na2SO4,CaCO3+2HCl===CaCl2+H2O+CO2↑。
b.自然界中矿物的转化:原生铜的硫化物氧化、淋滤,CuSO4溶液→铜蓝(CuS),反应为CuSO4+ZnS===CuS+ZnSO4,CuSO4+PbS===CuS+PbSO4。
1.在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl,沉淀量不变。( )
2.任何难溶物在水中都存在沉淀溶解平衡,溶解度大小都可以用Ksp表示。( )
3.难溶电解质的溶度积Ksp越小,则它的溶解度越小。( )
4.当溶液中某离子浓度小于时,可视为该离子沉淀完全。( )
5.只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中的离子浓度无关。( )
6.KSP(AB2)小于KSP(CD),则的溶解度小于的溶解度。( )
7.可用FeS除去废水中的Hg2+、Ag+等,是因为HgS、Ag2S比FeS更难溶。( )
8.沉淀的转化只能由难溶的转化为更难溶的。( )
答案 (1)× (2)× (3)× (4)√ (5)√ (6)× (7)√(8)×