


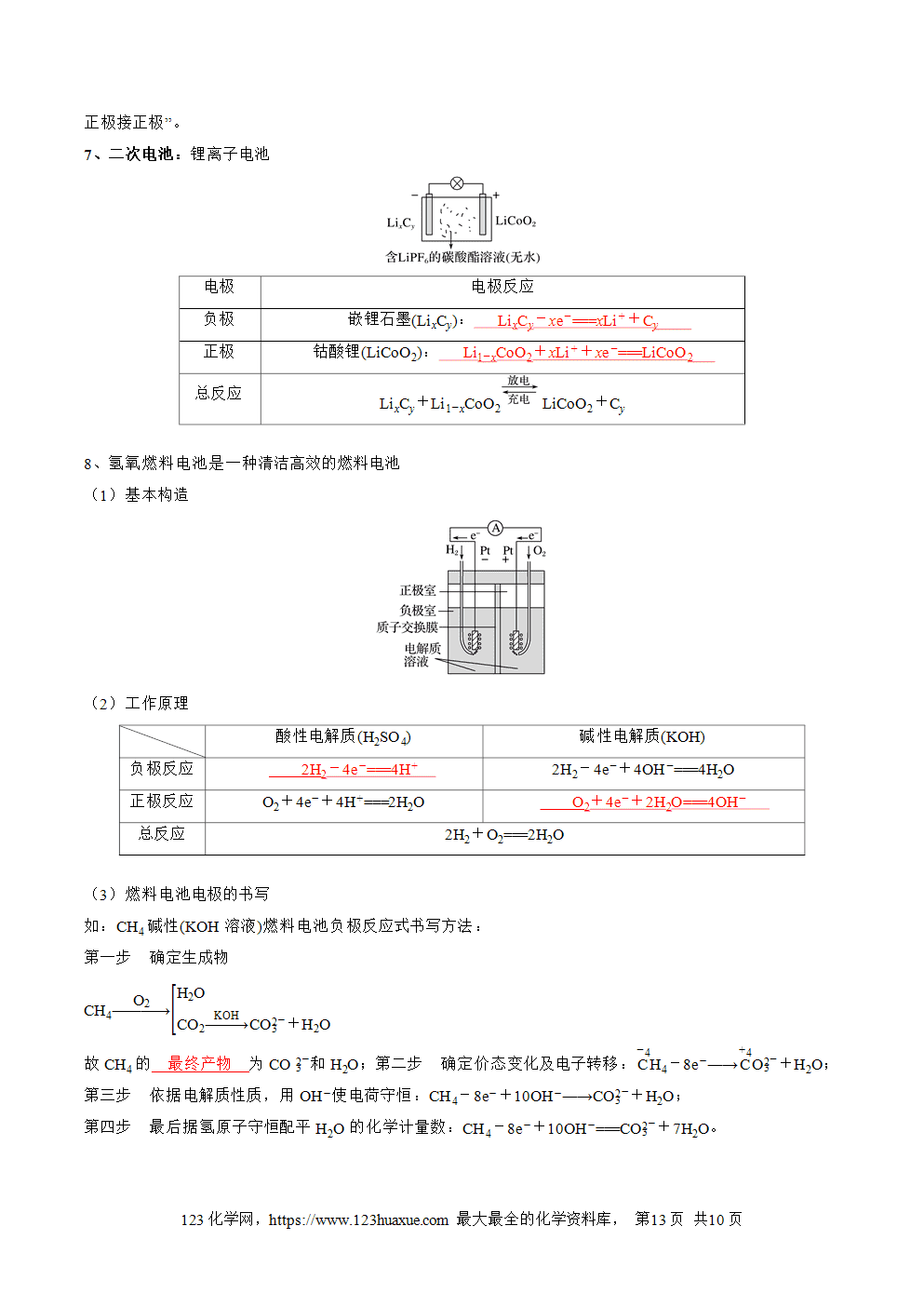
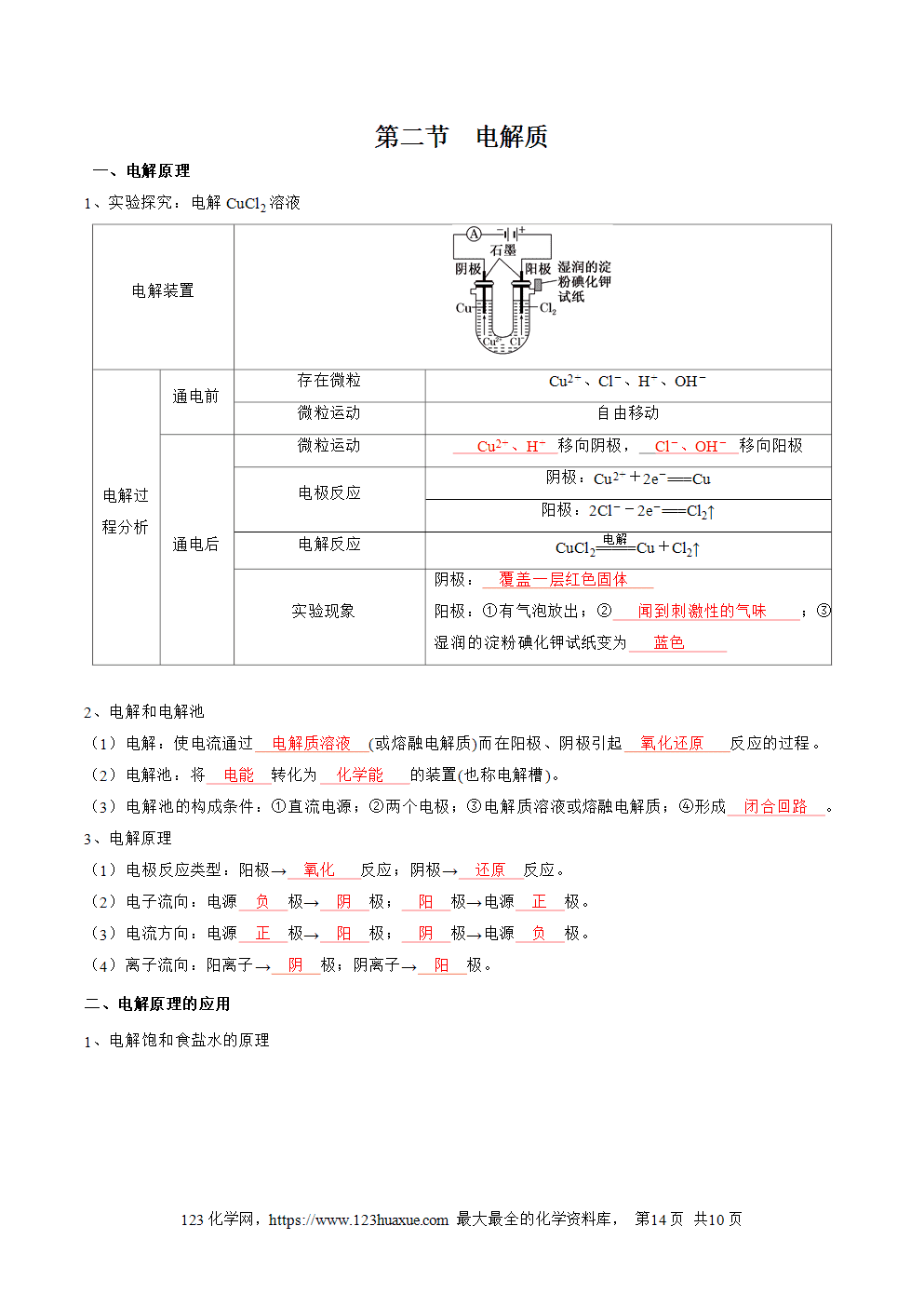

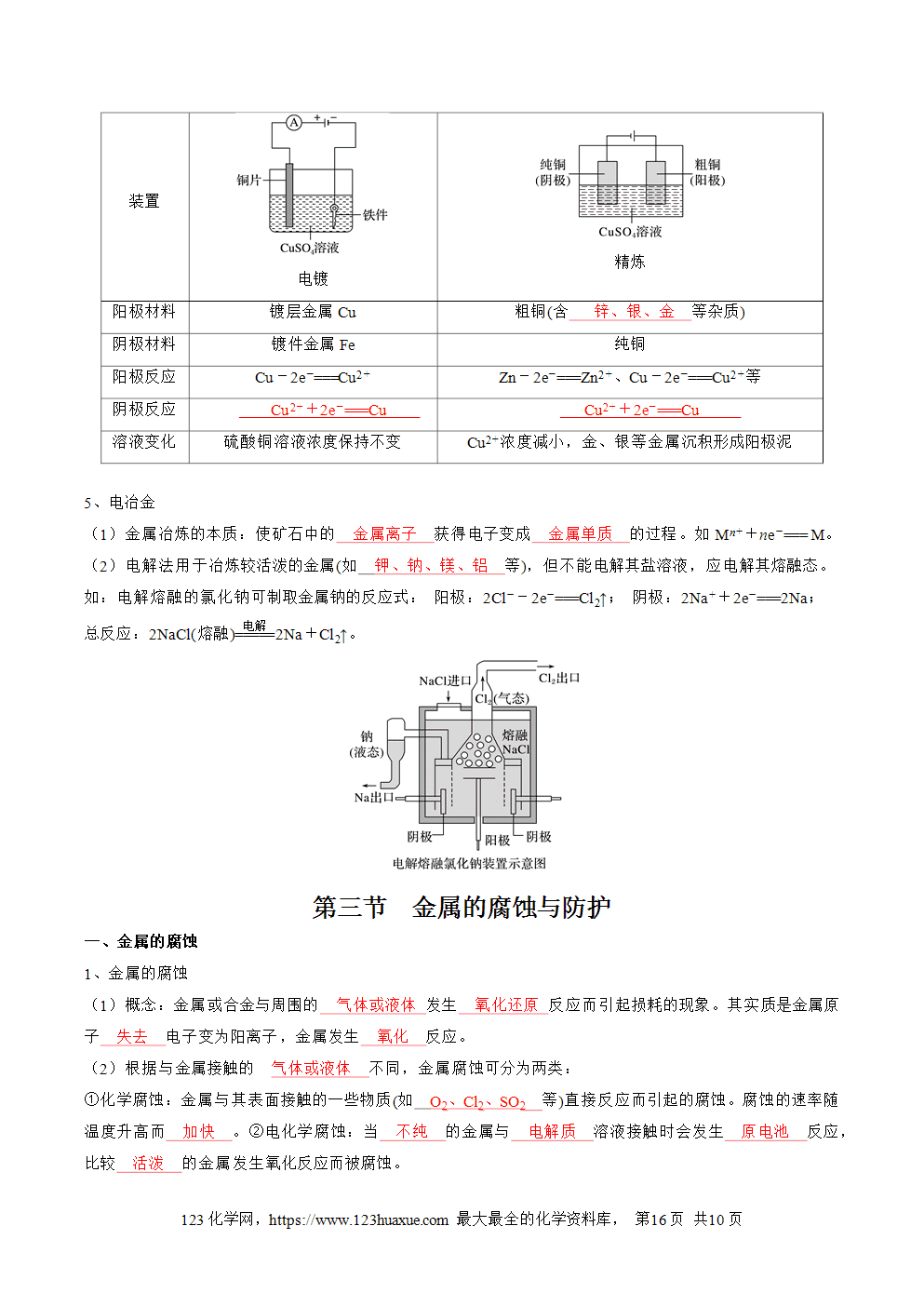
第四章 化学反应与电能
第一节 原电池
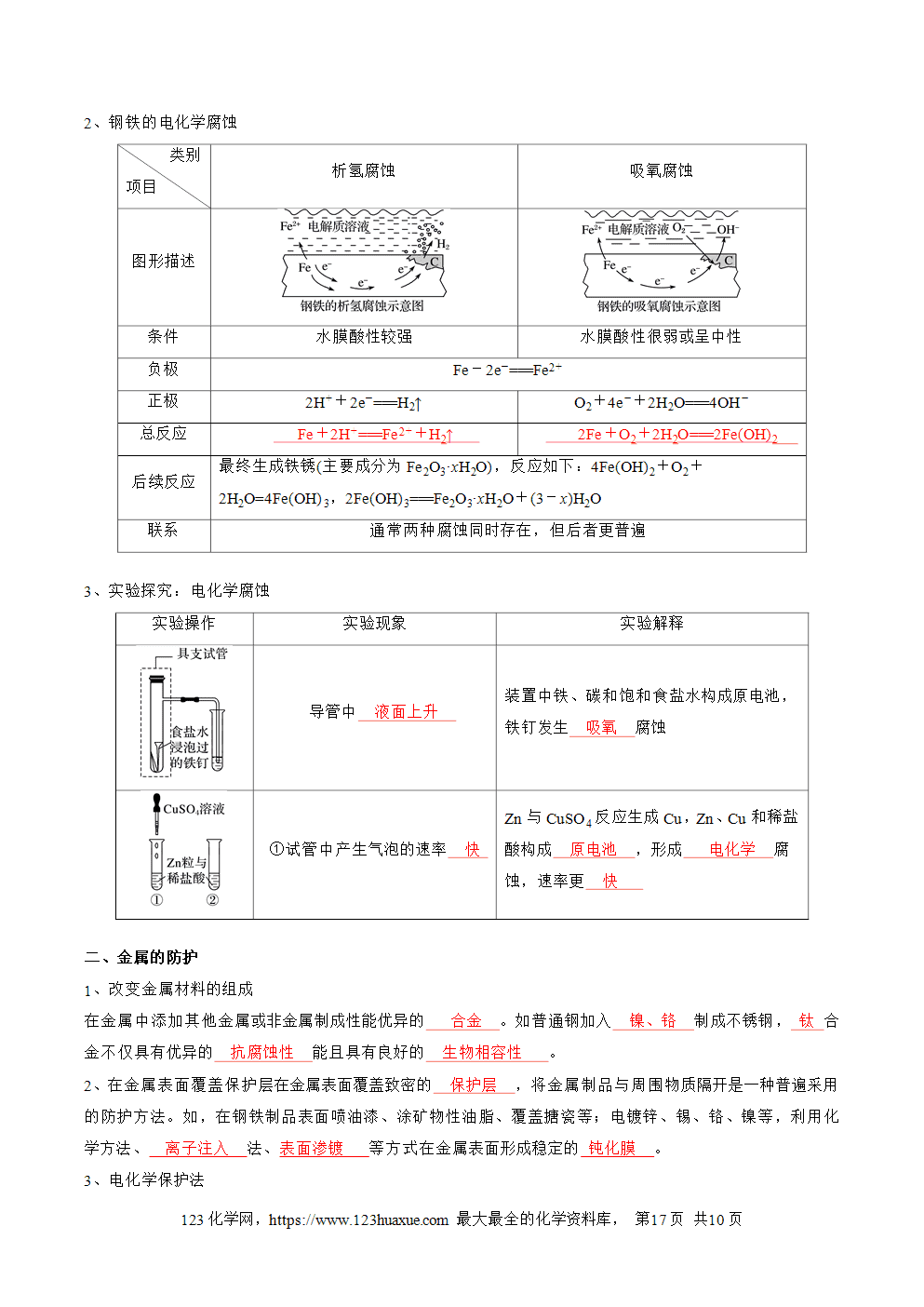
一、原电池的工作原理
1、原电池的构成条件
(1)定义:能把 化学能 转化为 电能 的装置。
(2)实质:利用能自发进行的 氧化还原 反应将化学能转化为电能。
(3)构成条件:①两个 活泼性不同 的电极;② 电解质 溶液;③形成 闭合 回路;④自发进行的氧化还原 反应。
2、实验4-1:锌铜原电池的工作原理
(1)ZnZnSO4半电池:在ZnSO4溶液中,锌片逐渐溶解,即Zn被 氧化 ,锌原子失去电子,形成Zn2+进入溶液,即Zn-2e-===Zn2+;从锌片上释放出的 电子 ,经过导线流向铜片。(2)CuCuSO4半电池:CuSO4溶液中的Cu2+从铜片上得到 电子 , 还原 为铜单质并沉积在铜片上,即Cu2++2e-===Cu。
(3)盐桥的作用:电池工作时,盐桥中的 Cl- 会移向ZnSO4溶液, K+ 移向CuSO4溶液,使两溶液均保持电中性。当取出盐桥后,形成断路,反应停止。
3、原电池工作原理
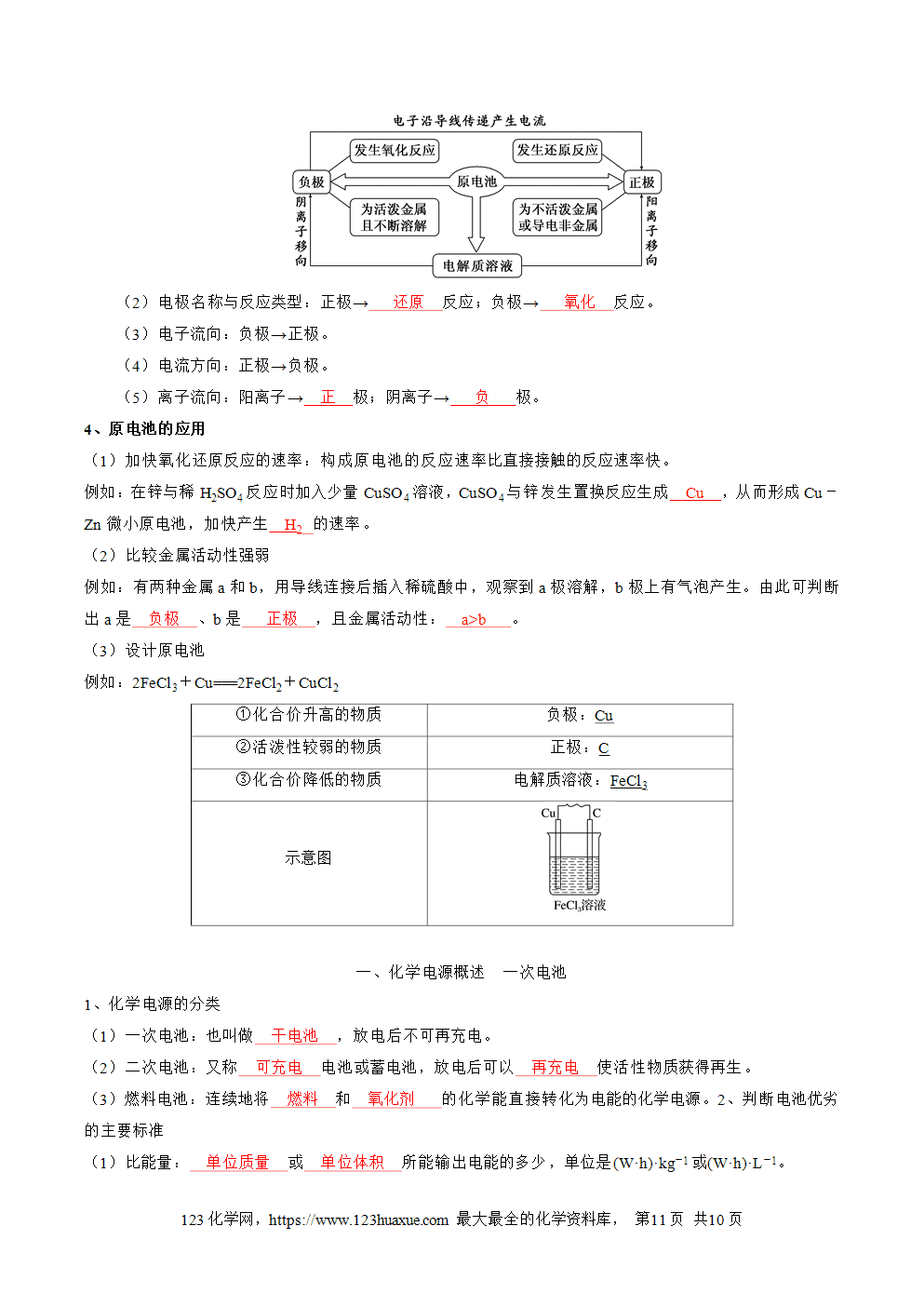
(1)原理图解
(2)电极名称与反应类型:正极→ 还原 反应;负极→ 氧化 反应。
(3)电子流向:负极→正极。
(4)电流方向:正极→负极。
(5)离子流向:阳离子→ 正 极;阴离子→ 负 极。