
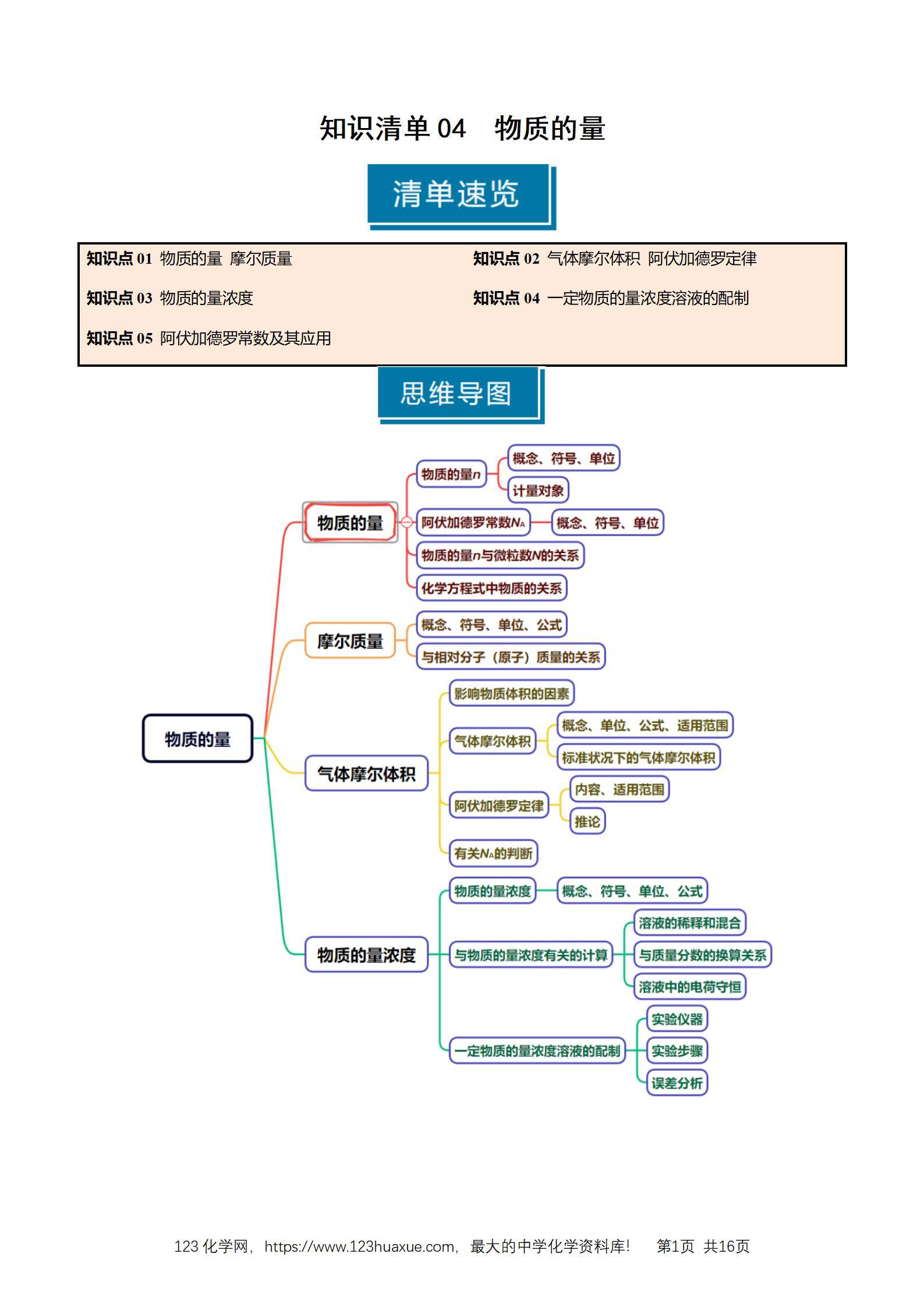












1.物质的量
(1)概念:物质的量是国际单位制中的七个基本物理量之一,用来表示一定数目微粒的集合体。符号为n,单位是摩尔(mol)。
(2)物质的量的规范表示方法
(3)计量对象:mol可以计量微观粒子(包括分子、原子、离子、原子团、质子、中子、电子等)。
2.阿伏加德罗常数
(1)国际上规定,1mol粒子集合体所含的粒子数约为6.02×1023。
(2)阿伏加德罗常数:1mol任何粒子的粒子数叫做阿伏加德罗常数。
符号:NA,通常用6.02×1023mol-1表示。
(3)物质的量、阿伏加德罗常数与微粒数目的关系:n=NA(N) 或N=n·NA或NA=n(N)
推论:微粒之间的物质的量之比等于微粒的粒子数之比。
3.摩尔质量
(1)概念:单位物质的量的物质所具有的质量称为该物质的摩尔质量。符号为M。
(2)常用单位:g·mol-1。
(3)数值:当粒子或物质的摩尔质量以g·mol-1为单位时,在数值上等于该粒子的相对分子(或原子)质量。
(4)公式:n=M(m)
(5)摩尔质量的计算
①根据物质的质量(m)和物质的量(n):M=n(m)。
②已知一个分子的质量时:M=m(分子)×NA。
③根据标准状况下气体的密度ρ:M=ρ×22.4 L·mol-1。
④根据气体的相对密度:D= ρ2(ρ1) = M2(M1)。
⑤对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……,a%、b%、c%……指混合物中各成分的物质的量分数(或体积分数)。
(1)物质的量是表示微粒数目多少的物理量(×)
错因:物质的量是表示含有一定数目粒子的集合体的物理量。
(2)1 mol任何物质都含有6.02×1023个分子(×)
错因:离子化合物不存在分子。
(3)硫酸的摩尔质量为98 g(×)
错因:摩尔质量的单位是g·mol-1。
(4)2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍(×)
错因:物质的摩尔质量与物质的量的多少无关。
(5)1 mol O2的质量与它的相对分子质量相等(×)
错因:1 mol物质的质量以g为单位时,在数值上等于其相对分子质量。