
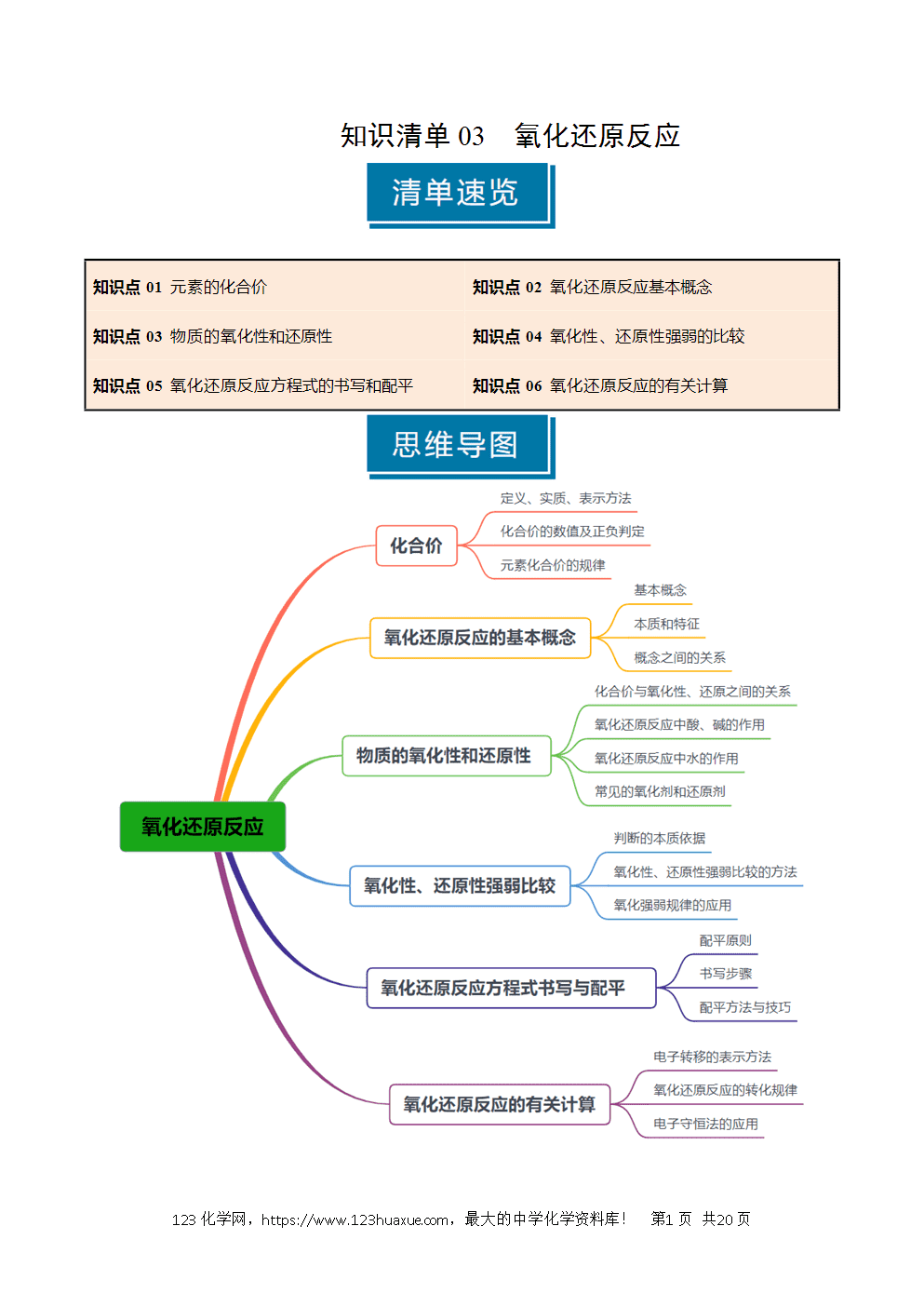
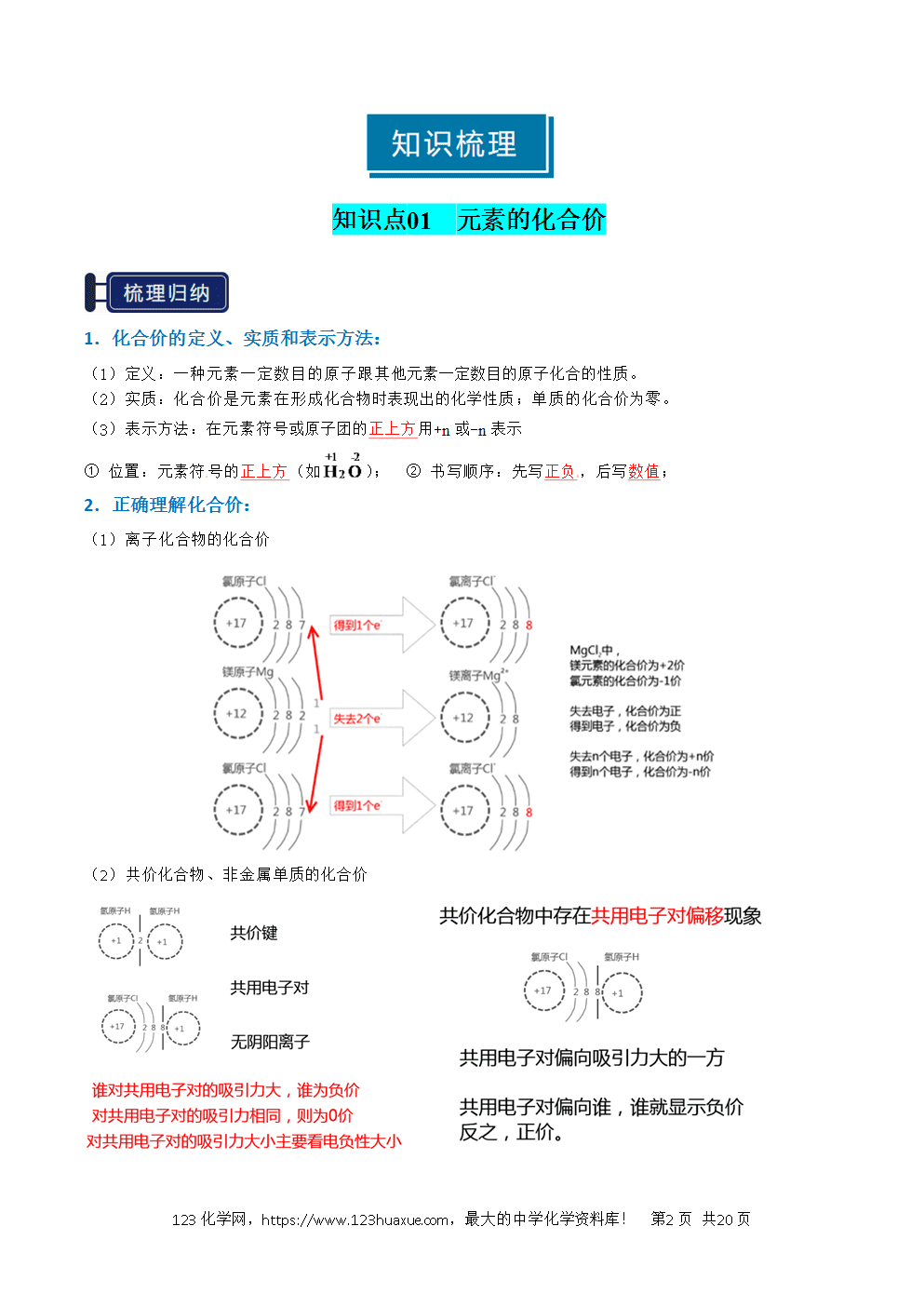















1.化合价的定义、实质和表示方法:
(1)定义:一种元素一定数目的原子跟其他元素一定数目的原子化合的性质。
(2)实质:化合价是元素在形成化合物时表现出的化学性质;单质的化合价为零。
(3)表示方法:在元素符号或原子团的正上方用+n或-n表示
① 位置:元素符号的正上方(如); ② 书写顺序:先写正负,后写数值;
2.正确理解化合价:
(1)离子化合物的化合价
(2)共价化合物、非金属单质的化合价
3.化合价的数值及正负判定
4.元素化合价的规律
(1)化合价原则:
①化合物中,正负化合价的代数和=0
②离子中,正负化合价的代数和=电荷
③在化合物里,氢通常显+1价,氧通常显-2价;
④金属元素通常显正价,非金属元素通常显负价,但在非金属氧化物里,氧显负价,另一非金属元素显正价;
⑤单质中元素的化合价规定为零;
⑥许多元素具有可变化合价,如:硫、碳等;
⑦“根”的化合价一定不为零。
(2)常用等量关系
①主族元素最高正价=主族序数=原子的最外层电子数
②主族元素的最高正价+|最低负价|=8或2
③最高正化合价与其最低负化合价代数和
a.等于0的短周期元素:H、C、Si b.等于2的短周期元素:N、P
c.等于4的短周期元素:S d.等于6的短周期元素:Cl
(3)化合价的范围:+1≤最高价≤+7,-4≤最低价≤-1