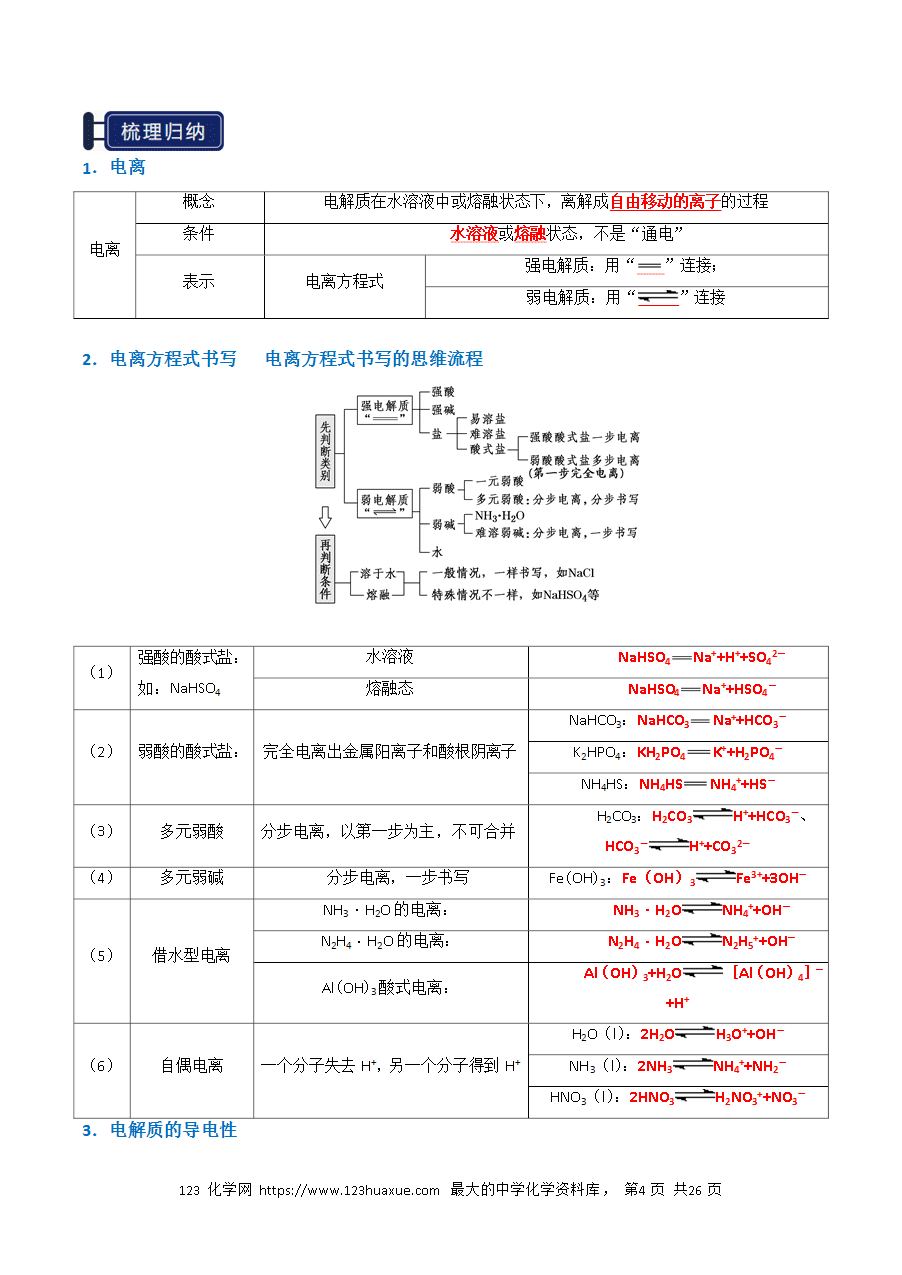
电解质的相关判断6个易错点
(1)电解质和非电解质的概念是仅对于化合物而言的,单质、混合物既不是电解质,也不是非电解质。
(2)电解质不一定导电,如固体NaCl、液态HCl均不导电;导电的物质不一定是电解质,如金属单质、电解质溶液均可导电,但都不是电解质。
(3)电解质是指自身电离能生成离子的化合物,有些化合物的水溶液能导电,但溶液中的离子不是它自身电离产生的,不属于电解质,如CO2、SO2、NH3、SO3等非电解质,它们与水反应生成的产物H2CO3、H2SO3、NH3·H2O、H2SO4是电解质。
(4)电解质的强弱是根据电离程度划分的,不能根据电解质溶液的导电性强弱划分强弱电解质。也不能根据电解质的溶解性的大小划分强弱电解质。
(5)电解质的强弱与物质溶解性无关,溶解度小的物质易被误认为是弱电解质。如BaSO4、AgCl等在水溶液中溶解度很小,但溶解部分完全电离,因此属于强电解质。溶液导电性强弱与自由离子的浓度及离子所带的电荷数有关,与电解质强弱无直接关系。
(6)电解质溶于水和加热熔融时破坏的化学键不一定一样,溶于水破坏离子键和某些共价键,而加热熔融只破坏离子键。