






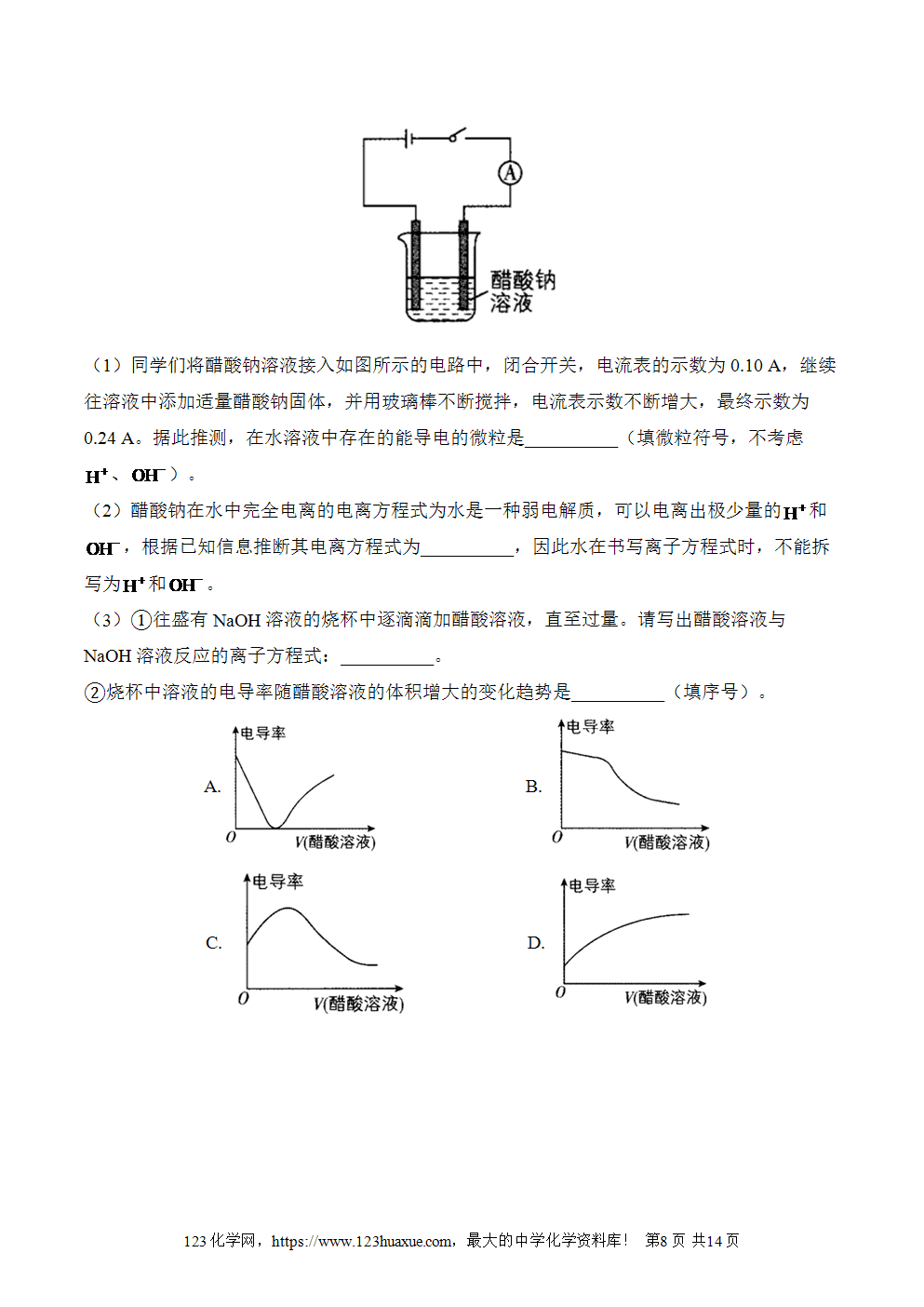





3)离子反应和离子方程式——初升高化学人教版教材衔接
知识衔接
1.中和反应:2NaOH+H2SO4===Na2SO4+2H2O可以表示为H++OH-===H2O,SO4(2-)和Na+没有参加反应。
H++OH-===H2O可以表示NaOH和HCl、KOH和H2SO4等生成可溶性盐和水的反应。
2.离子反应发生的条件
3.离子方程式的书写
(1)概念:用实际参加反应的离子符号来表示反应的式子。
(2)书写步骤
(3)离子方程式的正误分析
①看是否符合客观事实;②看是否符合拆写原则;③看是否遵守质量守恒定律;④看是否遵守电荷守恒;⑤看是否漏掉离子反应;⑥看是否符合阴、阳离子的个数配比;
⑧关于“微溶物”的拆写问题:
例:澄清石灰水可拆写成Ca2+和OH-,石灰乳则写成化学式Ca(OH)2。常见的微溶物有:Ca(OH)2、CaSO4、Ag2SO4、MgCO3。
4.离子反应的应用
(1)离子共存
① “无色透明”溶液中不存在有色离子。如Cu2+为蓝色、Fe3+为棕黄色、Fe2+为浅绿色、MnO4-为紫红色。“透明”不等于“无色”。
②生成难溶或微溶物质的离子不能大量共存。
生成难溶性的盐:Ca2+与CO3(2-),Ba2+与CO3(2-)、SO4(2-),Ag+与Cl-等。
生成难溶性的碱:OH-与Cu2+、Fe2+、Fe3+、Mg2+、Al3+等。
生成微溶物质:如Ag+与SO4(2-),Ca2+与SO4(2-)、OH-,Mg2+与CO3(2-)等。
③生成气体的离子不能大量共存:H+与CO3(2-)、HCO3(-)等。
④生成水或其他难电离物质的离子不能大量共存:H+与OH-、CH3COO-等。
常见难电离的物质:H2O;弱酸:CH3COOH、H2CO3、HClO、H2S、H2SO3等;弱碱:Al(OH)3、Cu(OH)2、Fe(OH)3、Fe(OH)2等。
(2)离子的检验
①CO3(2-):向待测液中加入BaCl2溶液,有白色沉淀生成,沉淀溶于稀盐酸或稀硝酸,生成无色无味且能使澄清石灰水变浑浊的气体,证明有CO3(2-)。
②SO4(2-):向待测液中加入稀盐酸,无明显现象,然后加入几滴BaCl2溶液,有白色沉淀产生,证明有SO4(2-)。
③Cl-:向待测液中加入几滴稀硝酸,然后加入几滴AgNO3溶液,有白色沉淀产生,证明有Cl-。
巩固练习
1.下列各组物质间的反应不属于离子反应的是( )
A.锌和稀硫酸反应 B.铁丝在氧气中燃烧
C.氯化钡溶液和硫酸钠溶液反应 D.烧碱溶液和硫酸铜溶液反应
2.下列各组物质混合,不会发生离子反应的是( )
①溶液和NaOH溶液
②溶液和稀盐酸
③稀硝酸和溶液
④溶液与稀硝酸
⑤铜与稀盐酸
⑥铁粉与溶液
A.只有①③ B.只有②③ C.只有①③⑤ D.只有②④⑥