





周末练2 离子反应
[分值:50分]
完成下列电离方程式
(1)H2SO4===2H++S。
(2)NaOH===Na++OH-。
(3)(NH4)2SO4===2N+S。
(4)硫酸氢钠:在水溶液中NaHSO4===Na++H++S,
在熔融状态下NaHSO4===Na++HS。
(5)NaHCO3===Na++HC。
[1~10题,每题3分]
一、 电解质的电离
1.(2024·济南期末)下列说法正确的是( )
A.氯化铵溶液、盐酸都能导电,所以它们都属于电解质
B.SO2的水溶液可以导电,但SO2是非电解质
C.NaCl溶于水,在通电条件下才能发生电离
D.次氯酸、纯碱、硫氰化钾、干冰分别属于酸、碱、盐、氧化物
答案 B
解析 氯化铵溶液、盐酸都是混合物,既不是电解质也不是非电解质,A错误; SO2的水溶液可以导电,是因为二氧化硫和水生成亚硫酸,亚硫酸可以电离出自由移动的离子,亚硫酸为电解质,但SO2是非电解质,B正确;纯碱是碳酸钠,属于盐,D错误。
2.(2024·天津期中)下列物质在水中的电离方程式书写正确的是( )
A.KClO3===K++Cl-+3O2-
B.Fe(NO3)3===Fe2++3
C.Al2(SO4)3===2Al 3++3
D.NaHCO3===Na++H++
答案 C
解析 Cl不可拆分,电离方程式为KClO3===K++,A错误;硝酸铁的电离方程式为Fe(NO3)3===Fe3++3N,B错误;碳酸氢钠的电离方程式为NaHCO3===Na++HC,D错误。
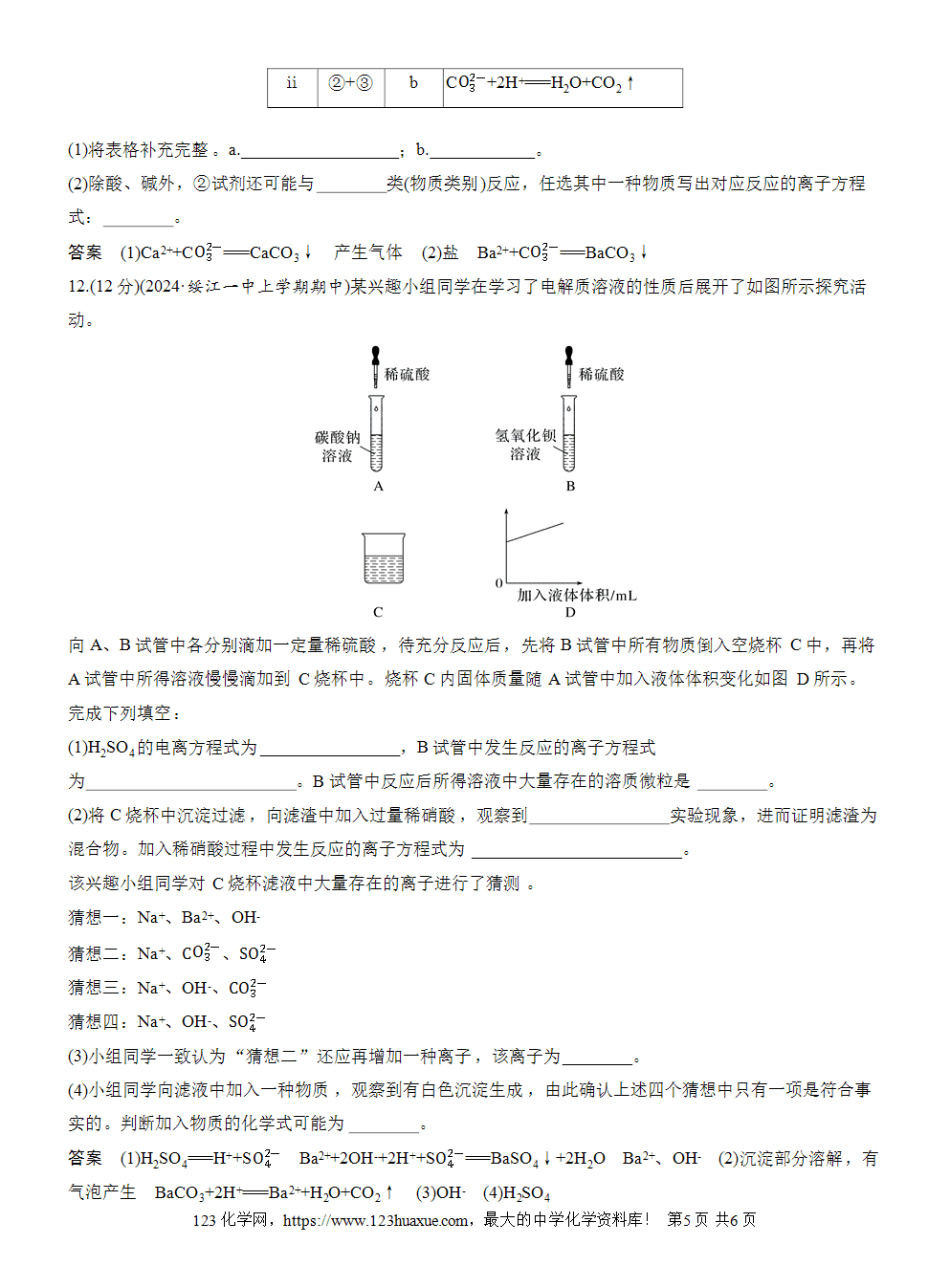
3.★★(2024·湖南张家界期末)某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于图像的说法正确的是( )
A.a时刻Ba(OH)2溶液与稀硫酸不一定恰好完全中和
B.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
C.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
D.BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
答案 C
解析 a时刻酸碱恰好完全反应生成硫酸钡和水,所以溶液几乎不导电,A错误;AB段反应生成硫酸钡沉淀,硫酸钡是不溶于水的强电解质,B错误;B处溶质是硫酸钡,在水溶液中电离出的离子浓度极小,导电能力接近为0,说明溶液中几乎没有自由移动的离子,C正确;BC段稀硫酸过量,硫酸电离出H+和S而使溶液导电,D错误。
二、 离子反应及离子方程式
4.(2024·河北廊坊高一月考)下列实验能发生离子反应的是( )
A.CO还原氧化铜
B.硫酸与KCl溶液混合
C.Cu片放入ZnSO4溶液
D.KOH溶液与CuSO4溶液混合
答案 D
解析 CO还原氧化铜,没有离子参加,不属于离子反应,A错误;硫酸与KCl溶液不发生反应,Cu片放入ZnSO4溶液不反应,B、C错误。
5.(2025·邵阳市海谊中学上学期期末) 下列化学方程式中,不能用离子方程式H++OH-===H2O表示的是( )
A.2NaOH+H2SO4===Na2SO4+2H2O
B.Ba(OH)2+2HCl===BaCl2+2H2O
C.KOH+KHSO4===K2SO4+H2O
D.Mg(OH)2+H2SO4===MgSO4+2H2O
答案 D
解析 氢氧化镁不溶于水,离子方程式中不能拆开,以化学式形式存在,故D不正确。
6.(2024·福建泉州期末)下列反应的离子方程式正确的是( )
A.铁锈溶于稀硫酸:O2-+2H+===H2O
B.澄清石灰水和少量碳酸氢钠反应:+OH-+Ca2+===CaCO3↓+H2O
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++===BaSO4↓+H2O
D.醋酸与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
答案 B
解析 氧化铁不能拆,反应的离子方程式为Fe2O3+6H+===2Fe3++3H2O,A错误;氢氧化钡溶液与硫酸反应生成硫酸钡沉淀和水:Ba2++2OH-+2H++S===BaSO4↓+2H2O,故C错误;在离子方程式中碳酸钙和醋酸都不能写成离子:CaCO3+2CH3COOH===Ca2++2CH3COO-+H2O+CO2↑,D错误。