二轮复习中需要特殊注意的高中化学教材内容(人教版)
教材不易学习到的内容-人教版高中化学必修一
绪言
1、17世纪中叶,化学开始走上以科学实验为基础的发展道路。
2、近代化学发展的几个重要里程碑:
(1)1661年,英国化学家波义耳提出元素的概念,标志着近代化学的诞生。
(2)1774年,法国化学家拉瓦锡提出燃烧的氧化学说,使近代化学取得了革命性的进展。
(3)1803年,英国科学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础。
(4)1811年,意大利科学家阿伏加德罗提出分子学说,使人们对物质结构德认识发展到一个新的阶段。
(5)1869年,俄国化学家门捷列夫发现元素周期律,使化学的研究变得有规律可循。
(6)分子结构学说的提出,原子结构的揭示,使人们对物质及其变化本质的认识发生了飞跃。
第一章 物质及其变化
1、与实验有关的图标及说明
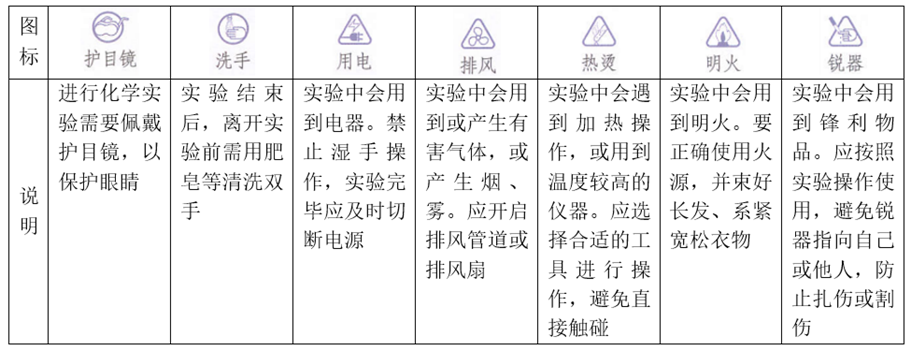
2、常见干燥剂
(1)酸性干燥剂:浓硫酸(不能干燥HI、HBr、H2S等还原性气体)、P2O5、变色硅胶(带钴盐的硅胶,未吸水时蓝色,吸水饱和后粉红色)。
(2)碱性干燥剂:生石灰、碱石灰。
(3)中性干燥剂:无水CaCl2(不能干燥NH3和乙醇等)、无水MgSO4(常用于干燥有机试剂)。
3、NaCl溶于水后,形成水合钠离子和水合氯离子。
4、阿伦尼乌斯电离模型
瑞典化学家阿伦尼乌斯提出,电解质溶于水自动解离为离子。
电离方程式写成:NaCl=Na++Cl-,NaCl=电离=Na++Cl-是对的。
电离方程式写成:NaCl=电解=Na++Cl-,NaCl=通电=Na++Cl-是错的。
5、牙膏中的摩擦剂:主要有碳酸钙CaCO3、磷酸氢钙(CaHPO4)、焦磷酸钙(Ca2P2O7)、水合硅酸(SiO2·nH2O)、氢氧化铝(Al(OH)3)等。
6、氧化还原反应概念的发展
(1)1774 年,法国化学家拉瓦锡提出燃烧的氧化学说(即燃烧是物质与氧气的反应)后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应。
(2)1852年, 英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念。此后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
(3)1897年, 英国物理学家汤姆孙发现了电子。在此基础上,人们将原子失去电子(或电子对偏离)的过程叫做氧化反应,把原子得到电子(或电子对偏向)的过程叫做还原反应。
7、汽车尾气系统中有催化转化器,其中CO和NO在催化剂的作用下发生反应,生成CO2和N2。化学方程式为:2CO+2NO=催化剂=2CO2+N2。
8、(1)高温下铝粉与氧化铁的反应可以用来焊接铁轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。化学方程式:2Al+Fe2O3=高温=Al2O3+2Fe。
(2)双氧水与氯气反应:H2O2+Cl2=2HCl+O2 (氯气的氧化能力比双氧水强)
WO3+3H2=高温=W+3H2O (钨的热还原法冶炼,钨显+6价)
(3)氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。(活泼金属氢化物及化学性质之一)
(4)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业上用铁盐和次氯酸盐在碱性条件下制备高铁酸钠的方法用离子方程式表示为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O。
高铁酸钠(Na2FeO4):铁为+6价,利用其强氧化性杀菌消毒,生成的Fe3+水解得到的Fe(OH)3胶体吸附一些杂质。
9、(1)维生素C又称“抗坏血酸”,具有较强的还原性,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,还可以用于饮料、食品中作为抗氧化剂。
注意:补铁剂中铁元素以Fe2+形式存在,Fe2+易于吸收,Fe3+不易被人体吸收。
(2)黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合(一硫二硝三炭)而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
(3)工业废水中的重铬酸铬离子(Cr2O42-)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:6Fe2++Cr2O42-+14H+=6Fe3++2Cr3++7H2O。
也可以用铁作阳极电解进行处理。
第二章 海水中的重要元素-钠和氯
1、索尔维制碱法又叫氨碱法。
CaCO3=高温=CaO+CO2↑
NaCl+NH3+CO2+H₂O=NaHCO3↓+NH4Cl
2NaHCO3=△=Na2CO3+CO2↑+H2O
CaO+H2O=Ca(OH)2,2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O
反应生成的CO2和NH3可重新作为原料使用。
总反应式为:CaCO3+2NaCl=高温=CaCl2+Na2CO3
优点是NH3可以循环利用,缺点是生成的CaCl2没有利用。
2、验证次氯酸光照分解产物的数字化实验
数字化实验将传感器、数据采集器和计算机依次相连,采集实验过程中各种物理量(如 pH、温度、压强、电导率等)变化的数据并记录和呈现,通过软件对数据进行分析,获得实验结论。
验证次氯酸光照分解的产物可以设计成数字化实验。
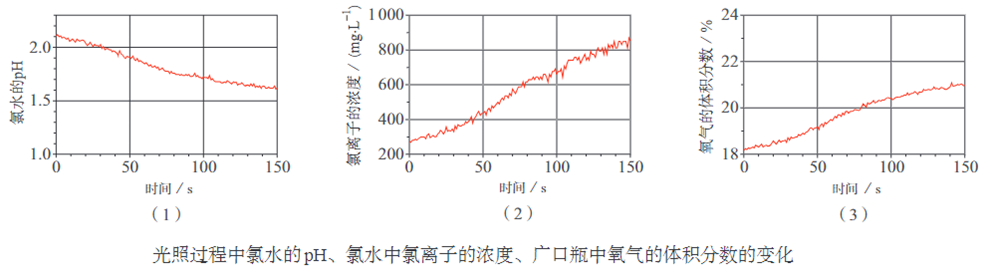
结论:次氯酸分解为盐酸和氧气。
3、(1)Al(OH)3:可做抗酸药。
(2)伴有发光、放热的氧化还原反应都可以称为“燃烧”。
4、(1)钠长期置于空气中的变化:Na→Na2O→NaOH→Na2CO3。
(2)“洁厕灵”(主要成分是稀盐酸),“84”消毒液(主要成分是 NaClO)。
第三章 铁 金属材料
1、检验蔬菜中的铁元素
(1)取新鲜的菠菜 10 g,将菠菜剪碎后放在研钵中研磨,然后倒入烧杯中,加入 30 mL蒸馏水,搅拌。将上述浊液过滤,得到的滤液作为试验样品。
(2)取少许试验样品加入试管中,然后加入少量稀硝酸(稀硝酸具有氧化性),再滴加几滴 KSCN 溶液,振荡,观察现象。
2、纯铝的硬度和强度较小,不适合制造机器零件等。硬铝含Cu4%等,密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。
3、新型合金:储氢合金(如Ti-Fe合金、La-Ni合金等)、钛合金、耐热合金、形状记忆合金等。
4、稀土元素(“冶金工业的维生素”):元素周期表中原子序数从57-71(从镧至镥,称为镧系元素)的15种元素以及钪和钇,共17种元素。
5、脱氧剂:(1)铁粉。氯化钠等作为催化剂。
(2)亚硫酸盐系脱氧剂,常用的是连二亚硫酸盐(Na2S2O4)。
(3)抗坏血酸。铜离子做催化剂。
(4)葡萄糖氧化酶,利用葡萄糖氧化成葡萄糖酸时脱氧。
第四章 物质结构 元素周期律
1、同位素的应用:考古时利用146C测定一些文物的年代;21H 和31H用于制造氢弹;235U用于制造核弹;利用放射性同位素释放的射线育种、给金属探伤、诊断和治疗疾病等。
1946年,美国芝加哥大学教授利比发明了146C断代法。
考古研究中还利用136 C和157N的测定,分析古代人类的食物结构,这对于研究当时的自然环境状况、社会生产力发展及社会文化风俗等具有重要参考价值。
2、元素周期表的发展
1789年,拉瓦锡在《 化学概要 》一书中提出了第一个元素分类表。
1829年,德国化学家德贝赖纳提出了“三素组”的概念,对于探寻元素性质的规律具有启发性。
1867年,俄国化学家门捷列夫在1869年2月编制了第一张元素周期表。后来的化学发现终于使门捷列夫元素周期表变得完整。
1905年,瑞士化学家维尔纳制成了现代形式的元素周期表。
1913年,英国物理学家莫塞莱发现并证明了周期表中元素的原子序数等于原子的核电荷数。
3、耐高温、耐腐蚀的铱合金用于制造发动机的火花塞。
附录
一、实验室突发事件的应对措施
1. 烫伤和烧伤:轻微烫伤或烧伤时,可先用洁净的冷水处理,降低局部温度,然后涂上烫伤药膏(若有水疱,尽量不要弄破)。严重时需及时就医。
2. 创伤:用药棉把伤口清理干净(伤口处若有碎玻璃片,先要小心除去),然后用双氧水或碘酒擦洗,最后用创可贴外敷。
3. 酸或碱等腐蚀性试剂灼伤如果不慎将酸沾到皮肤上,应立即用大量水冲洗, 然后用3% ~5%的 NaHCO3溶液冲洗;如果不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸。
如果有少量酸(或碱)滴到实验桌上,应立即用湿抹布擦净,然后用水冲洗抹布。
4. 着火:立即切断室内电源,移走可燃物。如果火势不大,用湿布或灭火毯覆盖火源以灭火;火势较猛时,选用合适的灭火器进行灭火,并立即与消防联系。
如果身上的衣物着火,立即用湿布灭火;如果燃烧面积较大,应躺在地上翻滚以达到灭火的目的。
二、常见废弃物的处理方法
1. 废液的处理
(1)对于酸、碱、氧化剂或还原剂的废液,应分别收集。在确定酸与碱混合、氧化剂与还原剂混合无危险时,可用中和法或氧化还原法,每次各取少量分次混合后再排放。
(2)对于含重金属(如铅、汞或镉等)离子的废液,可利用沉淀法进行处理。将沉淀物(如硫化物或氢氧化物等)从溶液中分离,并作为废渣处理;在确定溶液中不含重金属离子后,将溶液排放。
(3)对于有机废液,具有回收利用价值的,可以用溶剂萃取,分液后回收利用,或直接蒸馏,回收特定馏分。不需要回收利用的,可用焚烧法处理(注意:含卤素的有机废液焚烧后的尾气处理具有特殊性,应单独处理)。
2. 废渣的处理
(1)易燃物如钠、钾、白磷等若随便丢弃易引起火灾,中学实验室中可以将未用完的钠、钾、白磷等放回原试剂瓶。
(2) 强氧化剂如 KMnO4、KClO3、Na2O2等固体不能随便丢弃,可配成溶液或通过化学反应将其转化为一般化学品后,再进行常规处理。
(3)对于实验转化后的难溶物或含有重金属的固体废渣,应当集中送至环保单位进一步处理。
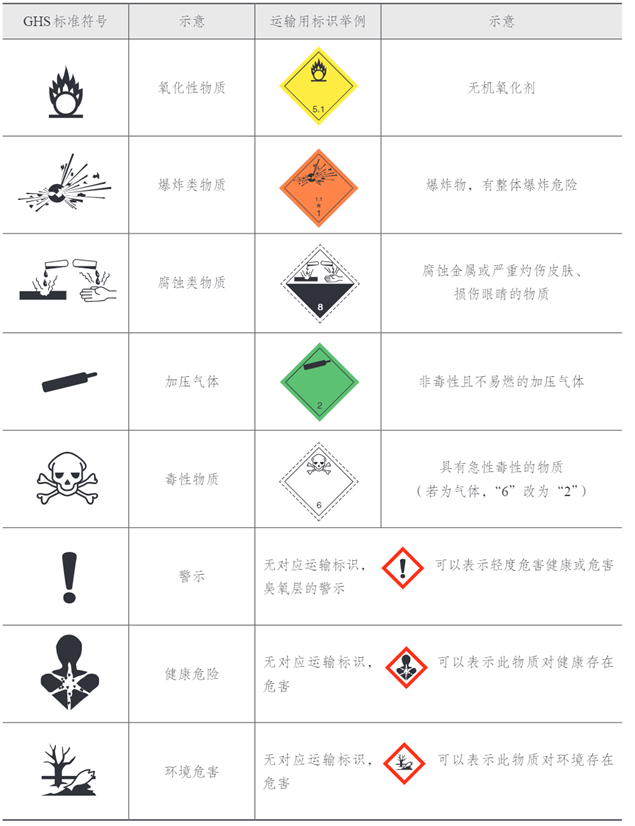
三、一些化学品安全使用标识
教材不易学习到的内容-人教版高中化学必修二
第五章 化工生产中的重要非金属元素
1、几种硫酸盐
(1)硫酸钙:自然界中的硫酸钙常以石膏(CaSO4·2H2O)的形式存在。石膏被加热到150°C时,会失去所含大部分结晶水而变成熟石膏(2CaSO4·H2O)。熟石膏与水混合成糊状物后会很快凝固,重新变成石膏。利用这种性质,石膏可被用来制作各种模型和医疗用的石膏绷带。
在工业上,石膏还被用来调节水泥的硬化速率。
(2)硫酸钡:自然界中的硫酸钡以重晶石(BaSO4)的形式存在。
重晶石是生产其他钡盐的原料。起始反应为:BaSO4+4C=高温=BaS+4CO↑,然后BaS通过水解制Ba(OH)2,通过与酸反应得到BaCl2、Ba(NO3)2等。
硫酸钡不溶于水和酸,且不容易被X射线透过,因此在医疗上可被用作消化系统X射线检查的内服药剂,俗称“钡餐”。
Ba(OH)2、BaCl2、Ba(NO3)2、BaCO3等都有毒。
(3)硫酸铜:硫酸铜(CuSO4)是白色的粉末,结合水后会变成蓝色晶体,俗称胆矾(CuSO4·5H2O)。
硫酸铜的这一性质可以用来检验酒精中是否含少量水。
胆矾可以和石灰乳混合制成一种常用的农药——波尔多液。
2、自然界中硫的存在及转化
硫元素广泛存在于自然界中,是植物生长不可缺少的元素,组成生命体的蛋白质中就含有硫。
(1)游离态的硫:存在于火山口附近或地壳的岩层中。
(2)硫化物:在岩层深处和海底的无氧环境下,硫元素与铁、铜等金属元素形成的化合物通常以硫化物的形式存在,如黄铁矿(FeS2)、黄铜矿(CuFeS2)等。
(3)硫酸盐:在地表附近,由于受氧气和水的长期作用,硫化物会转化为硫酸盐,如石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)等。
(4)二氧化硫、三氧化硫、亚硫酸、硫酸:火山口附近的硫单质会被大气中亚硫酸和硫酸的氧气氧化成二氧化硫,二氧化硫可被进一步氧化生成三氧化硫,二氧化硫和三氧化硫遇水分别形成亚硫酸和硫酸。
3、1909年,德国化学家哈伯发现,在500~600°C、17.5MPa~20.0MPa和锇为催化剂的条件下,反应后氨的含量可超过6%,具备工业化生产的可能性。
德国工程师博施在把哈伯合成氨的实验室方法转化为规模化的工业生产作出了重要贡献。
4、王水:浓硝酸和浓盐酸的混合物(体积比为1:3)叫做王水,能使一些不溶于硝酸的金属如金、铂等溶解。
Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O
3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO↑+8H2O
5、硅酸盐的结构:在硅酸盐中,Si和O构成了硅氧四面体。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、难溶于水、耐高温、耐腐蚀等特点。
6、传统无机非金属材料的制作
(1)陶瓷以黏土(主要成分是含水的铝硅酸盐)为原料高温烧结而成。
(2)玻璃的主要成分是Na2SiO3、CaSiO3、SiO2,它是以纯碱、石灰石、石英砂为原料,在玻璃窑中熔融,然后制成。
加铅元素后透光性好,折射率高。加硼酸盐后耐化学腐蚀,耐温度急剧变化。加一些金属氧化物或盐得到彩色玻璃。
(3)水泥用黏土、石灰石为主要原料在水泥回转窑中煅烧,加入适量石膏,磨成细粉制成。
水泥、沙子、碎石与水混合得到混凝土。
7、新型陶瓷:
高温结构陶瓷(碳化硅、氮化硅或某些金属氧化物等在高温下烧结而成)。
压电陶瓷(钛酸盐和锆酸盐等)。
透明陶瓷(氧化铝、氧化钇等氧化物透明陶瓷和氮化铝、氟化钙等非氧化物透明陶瓷)。
超导陶瓷。
8、碳纳米材料
富勒烯:由碳原子构成的一系列笼形分子的总称。
碳纳米管:石墨片层卷成的管状物,具有纳米尺度的直径。
石墨烯:只有一个碳原子直径厚度的单层石墨。
9、Na2SiO3的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,可用作黏合剂和防火剂。
实验室盛放碱溶液的试剂瓶应使用橡胶塞。
10、氮化硅(Si3N4)熔点高,硬度大,电绝缘性好,化学性质稳定,是一种性能优异的无机非金属材料。
由石英、焦炭在高温的氮气流中制备。化学反应方程式为:3SiO2+6C+2N2=高温=Si3N4+6CO。
第六章 化学反应与能量
1、冰敷袋常见的三种成分:
(1)冰 (2)NH4NO3与水 (3)NH4NO3与Na2CO3·10H2O
第七章 有机化合物
1、苯的历史
(1)19 世纪初,英国科学家法拉第发现了苯,并称为“氢的重碳化合物”。
(2)法国化学家热拉尔等人又确定了苯的相对分子质量为78,分子式为C6H6。
(3)奥地利化学家洛施密特曾提出苯具有环状结构。
(4)德国化学家凯库勒认为,苯分子中6个碳原子形成闭合的环状结构,由碳原子以单、双键相互交替结合而成(凯库勒式)。
(5)实际上,苯分子具有平面正六边形结构,相邻碳原子之间的键完全相同,其键长介于碳碳单键长之间。
2、蛋白质在工业上的应用
从动物皮、骨中提取的明胶可用作食品增稠剂,生产医药用胶囊和摄影用感光材料。
驴皮制的阿胶还是还是一种中药材。
从牛奶和大豆中提取的酪素可用来制作食品和涂料。
3、食用油中含不饱和脂肪酸的甘油酯,有碳碳双键,在空气中会被氧化,产生过氧化物和醛类等。有一种难闻的“哈喇”味,不能食用。市售的食用油中也普遍加入叔丁基对苯二酚(TBHQ)等抗氧化剂,以确保食品安全。
4、四氯乙烯是一种衣物干洗剂,聚四氟乙烯是家用不粘锅内侧涂层的主要成分。氟利昂-12(CF2Cl2)用于空调制冷。
第八章 化学与可持续发展
1、海水中含量最多的O、H两种元素,加上Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等11种元素,其总含量超过 99%,其他元素为微量。
2、石油经过常压蒸馏后得到石油气,汽油、煤油、柴油等含碳原子少的轻质油。
经过减压蒸馏后得到润滑油、石蜡、燃料油、沥青等重油。
通过催化裂化过程将重油裂化为汽油等,再进一步裂解获得乙烯、丙烯、甲烷等重要的基本化工原料。
石油在加热和催化剂的作用下,通过结构的调整,使链状烃转化为环状烃,如苯或甲苯等。
3、SnO2+C=高温=Sn+2CO↑
2PbS+3O2=高温=2PbO +2SO2
UF4+Mg=高温=U+MgF2
4、铜绿(碱式碳酸铜):Cu2(OH)2CO3。孔雀石的主要成分为 CuCO3·Cu(OH)2。蓝铜矿的主要成分为2CuCO3·Cu(OH)2。
5、化学品可以分为大宗化学品和精细化学品两大类。乙烯、硫酸、纯碱和化肥等属于大宗化学品,医药、农药、日用化学品、食品添加剂等属于精细化学品。
6、人类早期使用的农药有除虫菊、烟草等植物和波尔多液、石灰硫黄合剂等无机物。后来,人们研制出了有机氯农药、有机磷农药、氨基甲酸酯和拟除虫菊酯类农药等有机合成农药,使农药向着高效、低毒和低残留的方向发展。
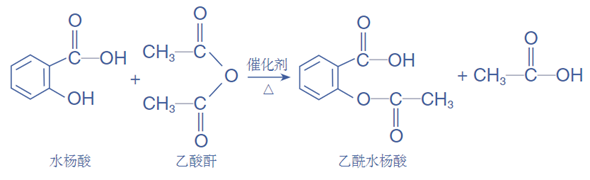
7、水杨酸和乙酰水杨酸
8、青蒿素类药物:抗疟疾。
9、食品添加剂
(1)着色剂、增味剂
天然色素常见的有红曲红、β- 胡萝卜素、姜黄、叶绿素铜钠盐、焦糖色等。
合成色素常见的有苋菜红、柠檬黄、靛蓝等。
味精是一种常用的增味剂,其主要成分为谷氨酸钠:NaOOCCH2CH2CH(NH2)COOH。
(2) 膨松剂、凝固剂
膨松剂有碳酸氢铵、碳酸氢钠等。
制作豆腐用的氯化镁、硫酸钙、葡萄糖酸 -δ- 内酯。
(3)防腐剂、抗氧化剂
苯甲酸及其钠盐(用于果汁、酱油、醋、酱、腌菜)、山梨酸及其钾盐(用于糕点、熟肉、半成水产品)是防腐剂。
亚硝酸钠(用于腊肉、香肠)是一种防腐剂和护色剂。
抗坏血酸(即维生素 C,用于果汁或水果)、丁基羟基茴香醚(用于油脂)是抗氧化剂。
(4)营养强化剂
食盐中加碘酸钾,在奶粉中添加维生素、碳酸钙、硫酸亚铁、硫酸锌等。
10、食品添加剂使用时应符合以下基本要求:
① 不应对人体产生任何健康危害;
② 不应掩盖食品腐败变质;
③ 不应掩盖食品本身或加工过程中的质量缺陷,或以掺杂、掺假、伪造为目的而使用食品添加剂;
④ 不应降低食品本身的营养价值;
⑤ 在达到预期效果的前提下尽可能降低在食品中的使用量。
在下列情况下可使用食品添加剂:
① 保持或提高食品本身的营养价值;
② 作为某些特殊膳食用食品的必要配料或成分;
③ 提高食品的质量和稳定性,改进其感官特性;
④ 便于食品的生产、加工、包装、运输或者储藏。
11、污水的三级处理:
(1)一级处理通常采用物理方法,即用格栅间、沉淀池等除去污水中不溶解的污染物。经过一级处理后的水一般达不到排放标准,所以通常将一级处理作为预处理。
(2)二级处理采用生物方法(又称微生物法)及某些化学方法,除去水中的可降解有机物等污染物。经过二级处理后的水一般可达到国家规定的排放标准。
(3)三级处理主要采用化学沉淀法、氧化还原法、离子交换法和反渗透法等,对污水进行深度处理和净化。经过三级处理后的水可用于绿化和景观用水等。
12、甲基丙烯酸甲酯是合成有机玻璃的单体。
旧的合成方法是:
(CH3)2C=O+HCN→(CH3)2C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4→
CH2=C(CH3)COOCH3+NH4HSO4
新的合成方法是:
CH3C≡CH+CO+CH3OH→CH2=C(CH3)COOCH3
13、腈纶是由丙烯腈(CH2=CHCN)聚合而成。
丙烯主要来自石油的裂解,例如:C10H22→2C3H6+C4H10。
丙烯腈可以由丙烯与氨和氧气反应制得,化学方程式为
2CH2=CHCH3+2NH3+6O2→2CH2=CHCN+6H2O。
14、用金红石(主要成分为TiO2)为原料生产钛的步骤主要有:
①在高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体;
化学方程式为TiO2+2C+2Cl2=高温= TiCl4+2CO。
②在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到钛。
化学方程式为TiO2+2Mg=△/Ar= 2MgCl2+Ti。
15、乙烯生成环氧乙烷
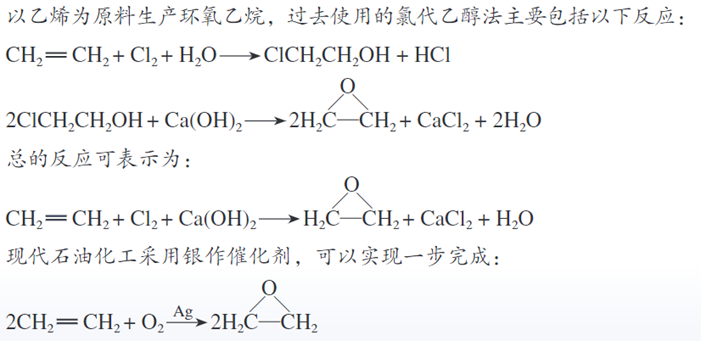
教材中不易学习到的内容-人教版高中化学选择性必修一 化学反应原理
第一章 化学反应的热效应
1、燃烧热中的生成指定产物:碳元素变为CO2(g),氢元素变为H2O(l),硫元素变为SO2(g),氮元素变为N2(g),磷元素变为P2O5(s),卤族元素变为HX(g)等。
2、研究与实践:了解火箭推进剂
(1)液氢和液氧。
(2)混肼-50(肼和偏二甲肼的50/50重量份混合物)和四氧化二氮。
肼:N2H4。偏二甲肼:(CH3)2N-NH2。
(3)RP-1高精炼煤油和液氧。
(4)肼和四氧化二氮。
3、最早研究反应热的是法国化学家拉瓦锡和法国数学家、天文学家拉普拉斯,他们利用冰量热计(即以被熔化了的冰的质量来计算热量)测定了碳单质的燃烧热。
第二章 化学反应速率与化学平衡
1、飞秒化学
要跟踪和检测化学反应中某些寿命极短的中间体或过渡态,必须采用10-15~10-12s的时间分辨技术,这种对超快速化学反应的研究被形象地称为飞秒(fs,1fs=10-15s)化学。
这些研究对了解化学反应机理、控制反应进程、充分利用物质和能源等非常重要。
2、研究与实践:汽车尾气及治理
(1)尾气的成分及其危害
固体悬浮颗粒:引起呼吸系统疾病,甚至激发恶性肿瘤。
一氧化碳:削弱血液向各组织输送氧的功能,危害中枢神经系统。
氮氧化物:对呼吸系统有危害。
碳氢化合物:与氮氧化物形成光化学烟雾,引起眼睛红肿和喉炎。
铅:铅是有毒的重金属元素,积累中毒,可引发心血管系统疾病,并影响肝、肾等重要器官及神经系统。
二氧化硫:对呼吸系统有危害。还容易形成酸雨。
二氧化碳:造成温室效应。
(2)通过多种途径了解尾气的治理。
①我国汽车尾气的排放标准:2023年7月1日起全国实施的国六排放标准6B。
②汽车尾气三元催化转化技术
三元催化器,汽车排气系统中的机外净化装置,将汽车尾气排出的CO、HC(碳氢化合物)和NOx等转变为二氧化碳、水和氮气。
③柴油汽车的选择性催化还原(SCR)技术
选择性催化还原法是指柴油汽车尾气在催化剂的作用下,利用还原剂(如尿素)与烟气中的NOx生成N2和H2O。
3、1898年,德国的弗兰克和卡罗研究出了氮气与碳化钙(CaC2)、水蒸气反应制备氨的方法。
CaC2+N2=△=CaCN2+C (CaCN2氰氨基化钙)
CaCN2+3H2O=CaCO3+2NH3↑
4、1908年,德国化学家哈伯申请了循环法合成氨的专利。主要包括以下过程:气体通过高温催化剂;低温除氨后再次循环,通过高温催化剂;全过程在一定压强下进行;进出催化剂床的冷、热气体进行热交换;用蒸发成品氨来冷却离开催化剂的气体。1909年申报了高压专利,以及用锇作催化剂和用铀-碳化铀作催化剂的专利。
5、德国化学家博施进行工业化生产试验。所面临的问题有
(1)设计获得大量廉价原料气体的方法:采用水煤气(主要成分为H2和CO)作为氢气的来源;氮气由液化空气分离法提供。
(2)寻找高效、稳定的催化剂:最后筛选出了合成氨工业用催化剂:铁系催化剂。
(3)开发适合高温、高压下的合成设备:找到了用熟铁作衬里的办法。
哈伯完成了合成氨的基础开发工作,博施实现了合成氨的工业化,这种合成氨的工业方法被称为“哈伯-博施法”。
6、羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。制取方法如下:
CO(g)+H2S(g)⇌COS(g)+H2(g)
第三章 水溶液中的离子反应与平衡
1、盐类水解的应用:
(1)用Na2CO3溶液清洗油污时,加热可以增强去污效果,原因就在于升温可以促进Na2CO3的水解,使溶液中c(OH-)增大。
(2)在实验室中配制FeCl3溶液时,常将FeCl3晶体溶于较浓的盐酸中,然后加水稀释到所需的浓度,目的就是通过增大溶液中H+的浓度来抑制FeCl3的水解。
(3)人们常用可溶性的铝盐、铁盐作净水剂,就是利用Al3+、Fe3+的水解。Al3+水解生成的Al(OH)3胶体、Fe3+水解生成的Fe(OH)3胶体可以使水中细小的悬浮颗粒聚集成较大的颗粒而沉降,从而除去水中的悬浮物,起到净水的作用。
(4)如果盐的水解程度很大,则可用于无机化合物的制备。例如,用TiCl4制备TiO2的反应可表示如下:在制备时加入大量的水,同时加热,促使水解趋于完全,所得TiO2·xH2O经焙烧得到TiO2(类似的方法也可用于制备SnO、SnO2等)。TiO2的化学性质非常稳定,是一种白色颜料,广泛用于涂料、橡胶和造纸等工业。
2、明矾[化学式为KAl(SO4)2·12H2O]溶液呈酸性,原因是Al3+水解,Al3++3H2O⇌Al(OH)3+3H+。
3、在实验室配制 Na2S 溶液时,常滴加几滴 NaOH 溶液。
4、草木灰与铵态氮肥不能混合施用,其原因是草木灰中的K2CO3水解显碱性,铵态氮肥水解显酸性,混合施用相互促进水解,造成铵态氮肥生成氨气挥发,降低肥效。
5、Sb2O3(三氧化二锑)可用作白色颜料和阻燃剂等。在实验室中可利用SbCl3的水解反应制取Sb2O3(SbCl3的水解分三步进行,中间产物有SbOCl等),其总反应可表示为:2SbCl3+3H2O⇌Sb2O3+6HCl
为了得到较多的Sb2O3,操作时要将SbCl3缓慢加入大量水中,反应后期还要加入少量氨水。
6、SOCl2(亚硫酰氯)是一种液态化合物,沸点为77°C。
(1)SOCl2与水反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑。
(2)将AlCl3溶液蒸干并灼烧得不到无水AlCl3,而将SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,原因是AlCl3·6H2O中分解出来的结晶水,与SOCl2反应生成HCl,抑制了AlCl3的水解。
7、锅炉除水垢:为了除去水垢中的CaSO4,可先用Na2CO3溶液处理,使CaSO4转化为疏松、易溶于酸的CaCO3,然后用酸除去。
8、各种原生铜的硫化物经氧化、淋滤作用后可变成CuSO4溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢地使它们转化为铜蓝(CuS)。
9、氟化物预防龋齿的化学原理
牙齿表面的釉质层的主要成分是难溶的羟基磷灰石[Ca5(PO4)3OH]。
口腔中的细菌在分解食物的过程中会产生有机酸。有机酸产生的H+使羟基磷灰石溶解:Ca5(PO4)3OH+4H+=5Ca2++3HPO42-+H2O。
在牙膏中添加氟化物,能预防龋齿。氟离子能与羟基磷灰石发生反应,生成氟磷灰石[Ca5(PO4)3F]:Ca5(PO4)3OH(s)+F-(aq)=Ca5(PO4)3F(s)+OH-(aq)。氟磷灰石的溶解度比羟基磷灰石的小,更能抵抗酸的侵蚀。氟离子还能抑制口腔细菌产生酸。
添入牙膏中的氟化物有一氟磷酸钠(Na2PO3F)、氟化钠(NaF)和氟化锶(SrF2)等。
高氟地区的人群、6岁以下的儿童等不宜使用含氟牙膏。
10、研究与实践:了解水处理过程中的化学原理
(1)水的硬度以及常用的硬水软化的方法
①碳酸盐硬度(暂时硬度):主要是由钙、镁的碳酸氢盐[Ca(HCO3)2、Mg(HCO3)2]所形成的硬度,还有少量的碳酸盐硬度。
碳酸氢盐硬度经加热之后分解成沉淀物从水中除去。
②非碳酸盐硬度(永久硬度):主要是由钙镁的硫酸盐、氯化物和硝酸盐等盐类所形成的硬度。
这类硬度不能用加热分解的方法除去。
反渗透法能够实现降低水中各种离子,实现硬度的降低。
(2)工业锅炉水垢的主要成分、危害、处理方法
工业锅炉水垢的主要成分是CaCO3、Mg(OH)2、CaSO4、MgCO3等。
危害:硬垢导热性差,浪费燃料或电力。硬垢热胀冷缩和受力不均,增加锅炉爆裂甚至爆炸的危险性。硬垢会附着重金属离子。
处理方式:用酸溶解。
11、在化学分析中,以AgNO3标准溶液滴定溶液中的Cl-时,采用K2CrO4为指示剂,利用Ag+与CrO42-反应生成砖红色沉淀指示滴定终点。
第四章 化学反应与电能
1、锂离子电池
(1)是一种二次电池,主要依靠锂离子在正极和负极之间移动来工作。在充放电过程中,Li+在两个电极之间往返嵌入和脱嵌:充电时,Li+从正极脱嵌,经过电解质嵌入负极,负极处于富锂状态;放电时则相反。
(2)锂离子电池构造是把锂离子嵌入碳(石油焦炭和石墨)中形成负极。正极材料常用LixCoO2,也用LixNiO2和LixMn2O4等,电解液用LiPF6+二甲基碳酸酯(DMC)等。
(3)一种锂离子电池,其负极材料为嵌锂石墨,正极材料为LiCoO2(钴酸锂),电解质溶液为LiPF6(六氟磷酸锂)的碳酸酯溶液(无水)。该电池放电时的反应原理可表示如下。
负极:LixCy-xe-=xLi++Cy
正极:Li1-xCoO2+xLi++xe-=LiCoO2
总反应可表示为:LixCy+Li1-xCoO2=LiCoO2+Cy
(4)注意:锂离子电池不是锂电池。锂电池的负极为金属锂,锂离子电池的负极为石油焦炭和石墨。锂离子电池的反应温和,危险性低。
2、历史上第一个化学电源
1789年,意大利生理学家伽法尼发现挂铜钩的蛙腿接触铁栏杆就会抽搐。他认为这是“动物电”。
意大利物理学家伏打认为肌肉收缩可能是受到了电刺激。
伏打在1792~1796年发现只要两种不同的金属接触,中间隔着湿的硬纸等,都会起电。
伏打设计了一种能检验电量的验电器。
1799年,伏打研制了能维持一定电流的电堆。这种电堆能为科研、生产提供稳恒电源。
3、普通锌锰电池:
Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)
负极:Zn+2NH3-2e-=[Zn(NH3)2]2+
正极:2MnO2+2e-+2NH4+= 2MnO(OH)+2NH3
4、电解与元素的发现

5、电有机合成己二腈
阳极:H2O-2e-=1/2O2↑+2H+
阴极:2CH2=CHCN+2H++2e-=NC(CH2)4CN
总反应:2CH2=CHCN+H2O→电解→NC(CH2)4CN+1/2O2↑
6、用电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,电级反应为:
阳极:Fe-2e-=Fe2+
阴极:2H2O+2e-=H2↑+2OH-
处理过程中还发生反应:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3+
+7H2O,最后Cr3+以Cr(OH)3,Fe3+以Fe(OH)3形式除去。
7、白铁皮:薄钢板表面镀上一层锌。马口铁:薄钢板表面镀上一层锡。
发蓝处理:用化学方法在钢铁部件表面进行发蓝处理(生成一层致密的四氧化三铁薄膜)。
8、黄铜:铜锌合金。白铜:铜镍合金。青铜:原指铜锡合金,后来除黄铜﹑白铜以外的铜合金均称青铜。
9、锌银纽扣电池的总反应:Zn+Ag2O=ZnO+2Ag(碱性电池KOH为电解质)
10、一种用于心脏起搏器的微型电池的电极材料是石墨和锂,电解质溶液为等物质的量的LiCl、AlCl3溶解在SOCl2中形成的溶液。这种电池的总反应为
8Li+3SOCl2=6LiCl+Li2SO3+2S。
11、研究与实践:暖贴的设计与制作
暖贴的使用原料:铁粉、活性炭、蛭石、无机盐和水等。
暖贴的发热原理:电化学的氧化还原反应。
负极:Fe-2e-=Fe2+
正极:O2+2H2O+4e-=4OH-
总反应:2Fe+O2+2H2O=2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2Fe(OH)3=Fe2O3+3H2O
当撕开明胶层后,空气中的氧气进入与铁粉发生氧化反应,铁粉被氧化后就会释放出热量。其中,活性炭可以吸附空气中的水分,保证氧化过程顺利进行,同时还可以使热量均匀散发。蛭石则是一种防火材料,具有保温的作用,它和活性炭一起将铁粉散开,避免暖贴发热太快而导致灼伤。无机盐和水则作为催化剂,可以促使铁粉更快地氧化,加快热量的释放。
教材不易学习到的内容-高中化学人教版选择性必修二
引言
1、古希腊曾盛行一种叫做“原性论”的哲学,把世界万物的本原归结为四种基本性质——冷、热、干、湿;它们两两结合,便形成四种基本元素——土、水、气、火;四种元素再按不同比例结合,便得到世间万物。原性论认为物质的性质与变化决定了物质的组成与结构。
2、1933年,德国生物化学家、病理学家与细菌学家多玛克将对氨基苯磺酰胺应用于医学。磺胺药之所以能杀菌,是由于它的结构类似于细菌必须的营养物——对氨基苯甲酸。
3、贝壳的无机成分主要是CaCO3,外壳叫方解石,内层叫霰石。
第一章 原子结构与性质
第一节原子结构
1、1920年,丹麦科学家玻尔在他提出的氢原子模型基础上,提出构造原理。
1936年,德国科学家马德隆发表了以原子光谱事实为依据的完整的构造原理。
2、铯和铷是通过原子光谱发现的,其光谱图中有特殊的蓝光和红光。稀有气体氦是分析太阳光谱发现的。
3、离散的谱线
1814年,德国物理学家夫琅禾费发明了分光镜并用来观察太阳光,发现在太阳光谱中有570多条黑线(现知几千条),后人称之为夫琅禾费线。
1859年,德国科学家本生和基尔霍夫发明了光谱仪,证实了夫琅禾费线实质上是原子的吸收光谱,并一一找到对应的元素。
1913年,玻尔假设被束缚在原子核外的电子的能量是量子化的,所以原子光谱的谱线是离散的。
1925年,德国科学家洪特解释了复杂光谱,得出了过渡元素(包括铬和铜等)的光谱学基态原子的电子排布,为构造原理的确立奠定了基础。
4、稀有气体及其化合物的发现
1868年,天文学家洛克耶和杨森在太阳光谱中发现了一种新元素,定名为氦。20多年后,英国化学家拉姆齐在研究钇铀矿时发现了一种新气体,求助于光谱学家克鲁克斯,证实这种气体就是氦。在地球上氦也被发现了。
1892年,英国物理学家瑞利与英国化学家拉姆齐通过实验和光谱,发现了氩。
1898年,拉姆齐与人合作又在液态空气中发现了三种新元素,分别命名为氪、氖、氙。
1900年,发现放射性元素镭发生衰变释放的气体也是一种新元素,到1923年被最后定名为氡。
2006年,第七周期最后一种元素被人工合成,元素符号为Og,中文名称为奥气。
1962年巴特利特合成了氙的第一个化合物XePtF6,不久,在三个不同实验室里又分别合成了XeF2、XeF4和XeF6三种简单化合物。所有稀有气体都能形成化合物。
第二章 分子结构与性质
1、F-F的键能比Cl-Cl的键能低,N-H的键能比C-H的键能低。
C-O、N-O、O-O的键能依次降低。C=O、N=O、O=O的键能依次降低。
2、一些分子的空间结构模型
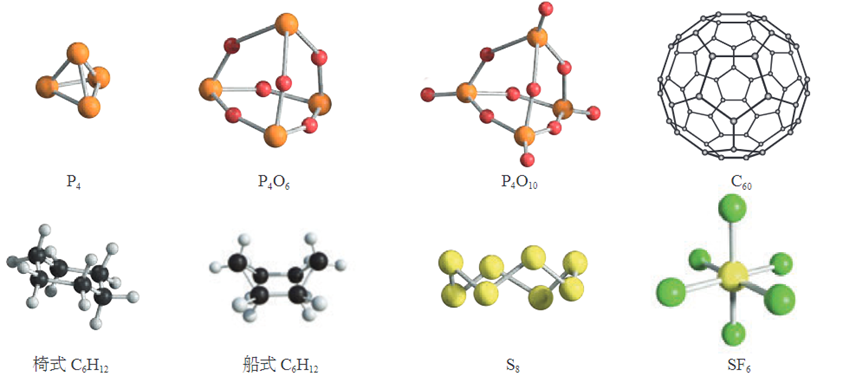
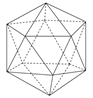 B12
B12
C60:12个正五边形和20个正六边形组成,又叫足球烯。
SF6:正八面体形。
椅式C6H12 比船式C6H12 稳定。
B12:正二十面体。
3、价层电子对互斥模型预测分子空间结构时,不能用于预测以过渡金属为中心原子的分子。
4、臭氧分子中的共价键是极性键,臭氧分子是极性分子。
5、表面活性剂和细胞膜
(1)表面活性剂的有机分子,分子的一端有极性,称为亲水基团,分子的另一端几乎没有极性,称为疏水基团。例如,烷基磺酸根离子R-SO3-。
表面活性剂在水中会形成亲水基团向外、疏水基团向内的胶束。由于油渍等污垢是疏水的,会被包裹在胶束内腔,这就是肥皂和洗涤剂的去污原理。
这些分子之所以称为表面活性剂,是由于它们会分散在水的液体表面形成一层疏水基团朝向空气的单分子层,又称单分子膜,从而大大降低水的表面张力。
6、邻羟基苯甲醛中的分子内氢键,发生在羟基的H和醛基的O上。
7、巴斯德与手性:1848年,法国科学家巴斯德发现,实验室合成的酒石酸盐与得自葡萄(发酵酿酒)的酒石酸盐不同,前者无光学活性(不能使偏振光的偏振面旋转),是因为合成的酒石酸盐有两种光学上不对称的晶体。他细心地通过实验把这两种不对称晶体成功分离,并证实它们都有光学活性。
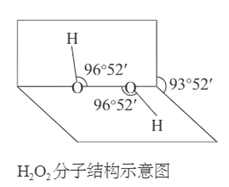
8、双氧水的分子结构为
第三章 晶体结构与性质
1、等离子体:由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体称为等离子体。
等离子体是一种特殊的气体。具有良好的导电性和流动性。在日光灯和霓虹灯的灯管里,在蜡烛的火焰里,在极光和雷电里,都能找到等离子体。
2、液晶:1888年,奥地利莱尼采尔发现,苯甲酸胆甾酯加热达到熔点后,先呈浑浊态,再加热达一定温度时,浑浊态变透明清亮态。
1889年,德国人莱曼将上述熔点至澄清点温度范围内的物质状态命名为液晶,后称热致液晶。相对于热致液晶,从溶液中获得的液晶称为溶致液晶,即胶束等。
液晶是介于液态和晶态之间的物质状态,既具有液体的流动性、黏度、形变性等,又具有晶体的某些物理性质,如导热性、光学性质等,表现出类似晶体的各向异性。
4、准晶:准晶,是一种介于晶体和非晶体之间的固体。在准晶的原子排列中,其结构是长程有序的(周期性),这一点和晶体相似;但是准晶不具备平移对称性,这一点又和晶体不同。
以色列科学家谢赫特曼在电子显微镜下观察到:铝锰合金的原子采用一种不重复、非周期性但对称有序的方式排列。这种准晶体也同斐波那契序列有关。随着数字的增大,两数间的比值越来越接近黄金分割率。准晶体中原子间的距离也完全符合黄金分割率。
5、金伯利岩富含金刚石。
(1)高压合成金刚石
用高压釜施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。
(2)低压合成金刚石
用甲烷等简单的碳氢化合物跟大量氢气混合,在微波炉里形成低温低压的等离子体在硅等基质上沉积,得到金刚石。这是目前合成高质量单晶金刚石的主要合成方式。
4、硬度:硬度是衡量固体软硬程度的指标。硬度有不同的标度,最普通的硬度标度是画痕硬度,即摩氏硬度,以固体互相刻画时出现刻痕的固体的硬度较低。金刚石不能被任何天然矿物刻画出刻痕,因而是最硬的。以金刚石的硬度为10,以另9种天然矿物为代表,可将摩氏硬度分为十度。
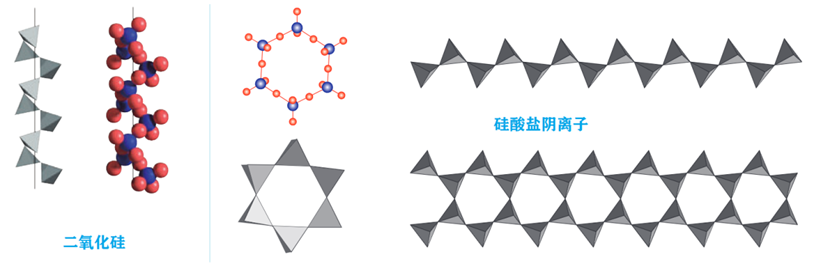
5、SiO2和硅酸盐的结构
在低温石英的结构中,顶角相连的硅氧四面体形成螺旋上升的长链,这一结构决定了它具有手性(左、右型)。
硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离子,如 SiO44-、Si2O76-、(SiO3)612-(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结合。部分 Si 被 Al 取代则得到铝硅酸盐。
6、离子液体:室温或稍高于室温时呈液态的离子化合物定义为离子液体。
离子晶体的熔点,有的较低,如NH4NO3、Ca(H2PO4)2的熔点分别为170°C、109°C。
引入有机基团可降低离子化合物的熔点,如C2H5NH3NO3的熔点只有12°C,常温下呈液态。
大多数离子液体含有体积很大的阴、阳离子。常见的阴离子如四氯铝酸根(AlCl4-)、六氟磷酸根(PF6-)、四氟硼酸根(BF4‑)等,常见的阳离子如季铵离子(R4N+,即NH4+的H被烃基R取代)、带烃基侧链的咪唑、嘧啶等有环状含氮结构的有机胺正离子等。
离子液体作溶剂,有难挥发的优点,这是由于离子液体的粒子全都是带电荷的离子。
离子液体有良好的导电性,用作电化学研究的电解质。许多离子液体被用作有机合成的溶剂和催化剂。
7、纳米晶体:纳米晶体是晶体颗粒尺寸在纳米(10-9m)量级的晶体。
纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性。以熔点为例,当晶体颗粒小至纳米量级,熔点会下降。
晶体颗粒小于200nm时,晶粒越小,金属铅的熔点越低,主要原因是晶体的表面积增大。
8、叶绿素、血红素和维生素 B12 都是配合物,它们的配体大同小异,是一种称为卟啉的大环有机化合物,而中心离子分别是镁离子、亚铁离子和钴离子。
9、硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
10、工业盐酸(俗称粗盐酸)呈亮黄色,已证明了这是配合物[FeCl4]-的颜色。
教材不易学习到的内容-高中化学人教版选择性必修三
引言
1、1828年,化学家维勒发现无机化合物氰酸铵(NH4OCN)通过加热可以直接转变为有机化合物尿素【CO(NH2)2】。化学方程式为:NH4OCN→△→CO(NH2)2
第一章有机化合物的结构特点与研究方法
1、范托夫与碳价四面体学说
荷兰化学家范托夫于1874年发表了《空间化学引论》。他认为在甲烷分子中,碳的4个价键指向正四面体的顶点,碳原子位于四面体的中心,氢原子位于四面体的4个顶点。
2、重结晶:首先要选择适当的溶剂,要求杂质在此溶剂中溶解度很小或溶解度很大,易于除去;被提纯的有机化合物在此溶剂中的溶解度受温度的影响较大,能够进行冷却结晶。
3、色谱法:当样品随着流动相经过固定相时,因样品中不同组分在两相间的分配不同而实现分离,称为色谱法。包括纸色谱、薄层色谱、气相色谱和高效液相色谱等。
1903 年,俄国植物生理学家和化学家茨韦特发表了第一篇关于色谱法的论文。他在玻璃管的一端塞上棉花,在管中填充碳酸钙粉末,再把溶有绿色植物色素的溶液自上而下注入玻璃管中。结果植物色素被碳酸钙粉末吸附,形成不同颜色的色带。他将吸附不同色素的碳酸钙分层取出,再用乙醇作溶剂,从植物色素中提取出叶绿素、叶黄素和胡萝卜素等较纯的组分。
4、青蒿素结构的测定:20世纪70年代初,我国屠呦呦等使用乙醚从中药中提取并用柱色谱分离得到抗疟有效成分青蒿素。科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。经红外光谱和核磁共振谱分析,确定青蒿素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(—O—O—)。通过X射线衍射最终测定了青蒿素的分子结构。
第二章烃
1、同种烷烃的不同异构体中,支链越多,沸点越低。
新戊烷的沸点9.5℃,常温下是气体,标准状况下是液态。
2、烷烃分子中可能存在以下结构单元:-CH3、-CH2-、-CH<、>C<。其中的碳原子分别被称为伯、仲、叔、季碳原子。
3、只有共轭二烯烃才能发生类似于丁二烯的1,4-加成。
共轭二烯烃的两个双键之间只有一个单键,比如CH2=CH-CH=CH2。
共轭二烯烃中有大π键。
4、顺-2-丁烯的熔点小于反-2-丁烯的。顺-2-丁烯的沸点大于反-2-丁烯的。顺-2-丁烯的密度大于反-2-丁烯的。
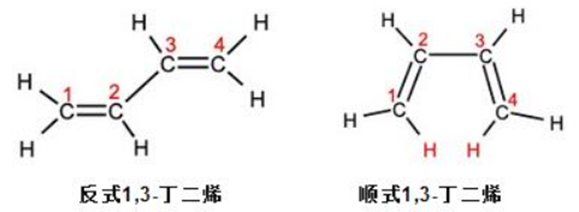
反-2-丁烯的分子间距更小,固体的熔点更高。顺-2-丁烯的分子极性更大,液体的沸点更高。
4、乙炔与水加成后的产物乙烯醇(CH2=CH-OH)不稳定,很快转化为乙醛。
这种结构变化叫重排反应,是有机化学反应的类型之一,多数会自动发生,符合能量最低原理。
5、导电高分子:聚乙炔、聚苯胺、聚苯等,具有共轭大π键的高分子,经过掺杂处理后具有一定的导电性能。聚乙炔掺杂I2后,具有与金属材料一样的导电性。
6、乙苯、邻二甲苯、间二甲苯、对二甲苯的物理性质比较
名称
熔点/℃
沸点/℃
密度/(g•cm-3)
乙苯
-95
136
0.867
邻二甲苯
-25
144
0.880
间二甲苯
-48
139
0.864
对二甲苯
13
138
0.861
分子结构越紧凑,越对称,分子间距越小,极性越大,熔沸点越高。
二甲苯、邻二甲苯、间二甲苯、乙苯的晶体中的分子间距依次增大,熔点依次降低。
邻二甲苯、间二甲苯、对二甲苯的极性依次变小,沸点降低。乙苯的分子间距更大,沸点最低。
7、溴苯(含少量苯、FeBr3、Br2)混合物的除杂步骤:(硝基苯中含少量苯、硝酸、硫酸的除杂步骤与之类似)
(1)稀酸洗,然后分液:除去FeBr3。(一般用水洗,此处用酸洗是防止FeBr3水解生成难溶性固体)
(2)NaOH溶液洗,然后分液:除去Br2。将更易溶于溴苯的Br2转化为易溶于水而难溶于溴苯的NaBr、NaBrO等)
(3)水洗,然后分液:再次除净残留的NaOH、NaBr等。
(4)加MgSO4固体,然后过滤:干燥,除去残留的水。
(5)蒸馏:除去苯。
8、稠环芳香烃——萘、蒽
由两个或两个以上的苯环共用相邻的两个碳原子的芳香烃是稠环芳香烃。
(1)萘C10H8:结构为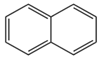 。无色片状晶体,有特殊气味,易升华。曾用于杀菌、防蛀、驱虫,有一定毒性,已不用。
。无色片状晶体,有特殊气味,易升华。曾用于杀菌、防蛀、驱虫,有一定毒性,已不用。
(2)蒽C14H10:结构为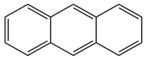 。无色晶体,易升华。可用于合成染料。
。无色晶体,易升华。可用于合成染料。
第三章烃的衍生物
第一节卤代烃
1、氯乙烷的应用
液态氯乙烷汽化时大量吸热,具有冷冻麻醉作用,可在身体局部产生快速镇痛效果。常用氯乙烷与其他药物制成“复方氯乙烷气雾剂”,用于运动中的急性损伤。
2、臭氧层的保护
大气中的臭氧层滤除大量紫外线,保护地球上的生物。大气中的臭氧在紫外线下发生反应:
O3→紫外线→O2+O·、O2+O·→O3。
氟氯代烷(商品名:氟利昂)破坏臭氧层的反应过程为:
CCl3F→紫外线→CCl2F·+Cl·
然后在Cl·的作用下,发生循环反应:Cl·+O3→O2+ClO·、ClO·+O·→Cl·+O2。
总反应为2O3→3O2。
3、有机物命名的次序为:羧酸、磺酸、羧酸酯、酰卤、酰胺、酸酐、腈、醛、酮、醇、硫醇、酚、硫酚、胺、炔烃、烯烃、醚、硫醚、卤代烃、烷烃、硝基化合物、亚硝基化合物……
用前面的官能团为主体命名,后面的官能团为取代基,取代基的书写顺序从后向前。
CH3-CH(NH2)-CHCl-CH(CN)-CH(CH=CH2)-CH(CH3) -CH(OH)-COOH:
3-甲基-6-氯-4-乙烯基-7-氨基-2-羟基-5-氰基辛酸。
4、乙二醇可用于生产汽车防冻液,丙三醇可用于配制化妆品。
5、甲醇是无色、易挥发的液体,有毒,误服会损伤视神经,甚至致人死亡。
6、乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚易溶于有机溶剂,它是一种优良溶剂。
7、苯酚有毒,对皮肤有腐蚀性。如不慎沾到皮肤上,应立即用乙醇冲洗,再用水冲洗。
8、酚类物质一般都可以与FeCl3作用显色,可用于检验其存在。
含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。
处理方法包括物理法(吸附法、萃取法、膜分离法)、化学法(氧化法、缩聚法、电解法)、生物法(活性污泥法、厌氧-好氧组合法)。
9、19世纪,英国外科医生利斯特发明了用苯酚(石炭酸)溶液对手术器械消毒,减少患者的伤口感染。
10、化学家波义耳用铁盐与没食子酸制造了墨水。没食子酸的结构为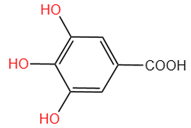 。
。
11、苯甲醛俗称苦杏仁油,是一种有苦杏仁味的无色液体。苯甲醛是制造染料、香料及药物的重要原料。在空气中久置,在容器内壁会出现苯甲酸固体的结晶。
安息香:可由两分子的苯甲醛制成,2C6H5-CHO→C6H5-CHOH-CO-C6H5。
12、苯丙烯醛又叫肉桂醛,结构为C6H5-CH=CH-CHO,可用作植物香料。
苯甲醛和乙醛可在热的碱性溶液中制肉桂醛。经历加成反应和消去反应,化学方程式为:
C6H5-CHO+CH3CHO→NaOH/△→C6H5-CHOH-CH2-CHO
C6H5-CHOH-CH2-CHO→C6H5-CH=CH-CHO+H2O
13、溴水中加入足量的乙醛溶液,发现溴水褪色。这是由于醛基具有还原性,溴水可将乙醛氧化为乙酸。化学方程式为:Br2+H2O=HBr+HBrO、HBrO+CH3CHO→HBr+CH3COOH。
14、甲酸(HCOOH)又称蚁酸,是无色、有刺激性气味的液体,有腐蚀性,能与水、乙醇等互溶。甲酸分子中既有羧基,又有醛基。甲酸既有酸性,又能与银氨溶液反应,被氧化为碳酸后分解生成二氧化碳和水。
它受热易分解。HCOOH→△→CO↑+H2O
15、苯甲酸(C6H5COOH,俗称安息香酸)是无色晶体,易升化,微溶于水,易溶于乙醇。它的钠盐是常用的食品防腐剂。
它受热易分解。C6H5COOH→△→CO2↑+C6H6
16、乙二酸(HOOC-COOH,H2C2O4,俗称草酸)是无色晶体,通常含有两分子结晶水,可溶于水和乙醇。乙二酸是化学分析中常用的还原剂,也是重要的化工原料。
它受热易分解。H2C2O4→△→CO2↑+CO↑+H2O
17、2-羟基丙酸(CH3CHOHCOOH俗称乳酸)是无色液体,具有吸湿性。存在于酸奶中,可由淀粉制得:淀粉→C6H12O6→乳酸菌→2CH3CHOHCOOH。
18、鲁宾和卡门利用同位素示踪法,通过标记18O来追踪光合作用中产物氧气的来源,证明了氧气中的氧全部来自水,而不是来自二氧化碳。
19、硬脂酸:C17H35COOH,软脂酸:C15H31COOH,油酸:C17H33COOH,亚油酸:C17H31COOH。由天然油脂得到的油酸和亚油酸一般具有顺式结构。
油脂经过氢化得到的人造脂肪中会含有反式脂肪酸。反式脂肪酸是引发动脉硬化和冠心病的危险因素之一。
20、研究与实践:自制肥皂
(1)制皂过程:①在皂化锅中,加入食用油和纯碱溶液,充分搅拌并加热,油脂层逐渐减少,最后液体不出现分层,说明皂化反应完成。
②加入NaCl细颗粒,在液体上方出现固体。
③用纱布过滤,干燥,成型,得到肥皂。
(2)了解表面活性剂的种类
表面活性剂分为离子型表面活性剂(包括阳离子表面活性剂、阴离子表面活性剂、两性表面活性剂)、非离子型表面活性剂等。
比如,阴离子表面活性剂有肥皂类、磺酸化物R-SO3-M等。
阳离子表面活性剂有主要有苯扎溴铵(新洁尔灭)等有机铵盐。
两性表面活性剂有卵磷脂等。
非离子型表面活性剂有脂肪酸甘油酯、蔗糖脂肪酸酯等。
21、(1)羟醛缩合反应
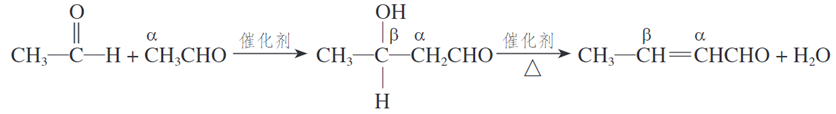
(2)第尔斯-阿尔德反应:
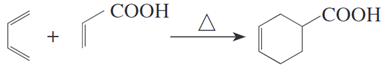
22、1,4-二氧杂环己烷(又称1,4-二氧六环或1,4-二𫫇烷,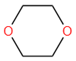 )是一种常用的溶剂,在医药、化妆品、香料等精细化学品的生产中有广泛应用。
)是一种常用的溶剂,在医药、化妆品、香料等精细化学品的生产中有广泛应用。
23、阿司匹林片的有效成分是乙酰水杨酸CH3COOC6H4COOH(苯环邻位),用于治疗发烧、发炎等。通过实验检验乙酰水杨酸中的羧基和酯基:
(1)样品处理:将一片阿司匹林片研碎后放入适量水中,振荡后静置,取用上层清液。
(2)阿司匹林片中羧基和酯基官能团的检验
①向两支试管中分别加入2mL清液。
②向其中一支试管中滴入2滴石蕊溶液,观察现象。
③向另一支试管中滴入2滴稀硫酸,加热后滴入几滴NaHCO3溶液,振荡。再向其中滴入几滴FeCl3溶液,振荡。观察现象。
24、下图是乙醇、乙酸和乙酸乙酯三种物质的核磁共振氢谱,请指出它们分别对应哪种物质。
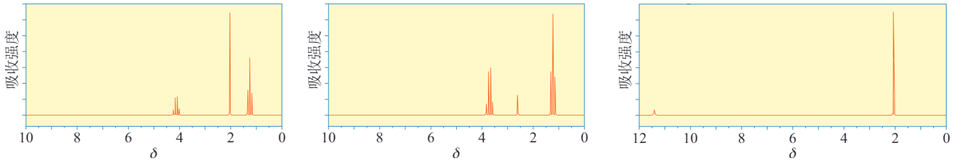
答案:乙酸乙酯、乙醇、乙酸
第四章生物大分子
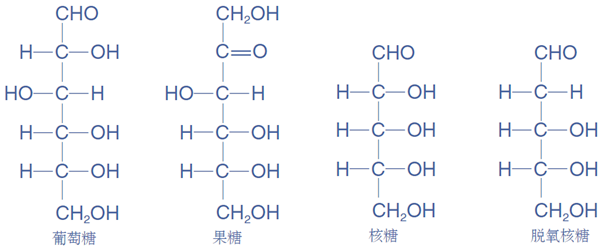
1、单糖结构式:(注意中间碳上的OH在左边和在右边,不是同种物质)
费歇尔投影式
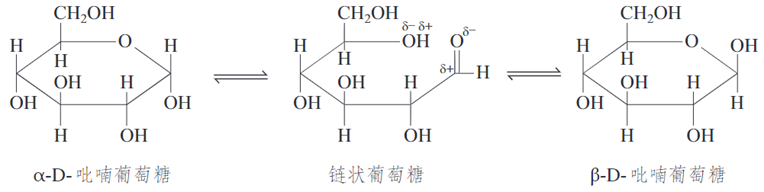
2、葡萄糖的环状结构(注意结构细节,下面还对比了其它六碳单糖的环状结构)
哈沃斯透视式(投影式)
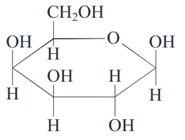 半乳糖,
半乳糖,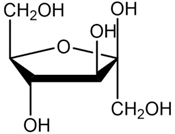 β-D-果糖
β-D-果糖
3、最简单的醛糖是丙醛糖,又称甘油醛,其结构简式为 CH2OHCHOHCHO。
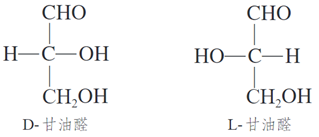
甘油醛的对映异构体如图所示,根据其构型不同分别称为D-甘油醛和L-甘油醛。自然界存在的葡萄糖和果糖都具有D构型。
D、L构型:1951年,德国化学家费歇尔采用(+)-甘油醛为标准物,并人为地规定在费歇尔投影式中第二号碳原子C2上的羟基,位于右侧的为D构型,位于左侧的为L构型。
4、乳糖C12H22O11:乳糖也是一种常见的二糖,主要存在于哺乳动物的乳汁中,可用于婴儿食品、糖果、药物等的生产。
C12H22O11(乳糖)+H2O→C6H12O6(葡萄糖)+C6H12O6(半乳糖)
5、甜味剂是能赋予食物甜味的食品添加剂,按其营养价值可分为营养性甜味剂和非营养性甜味剂,按其来源可分为天然甜味剂和合成甜味剂。天然甜味剂有木糖醇、甜菊糖苷、甘草等,合成甜味剂有阿斯巴甜、糖精钠等。
6、纤维素参与构成了植物的细胞壁,起着保护和支持作用。
纤维素可以用来制造纤维素硝酸酯、纤维素乙酸酯和黏胶纤维等。
纤维素硝酸酯又称硝酸纤维,极易燃烧,可用于生产火药、塑料和涂料等。
纤维素乙酸酯又称醋酸纤维,不易燃烧,是一种纺织工业原料,可用于生产塑料、过滤膜、胶片等。
黏胶纤维是用木材、秸秆等富含纤维素的物质经化学处理后,通过纺丝而制成的再生纤维。黏胶纤维中的长纤维一般称为人造丝,短纤维称为人造棉,都可用于纺织工业。
7、甲壳质:又称甲壳素、几丁质,化学式为(C8H13O5N)n,由乙酰氨基葡萄糖相互结合形成。
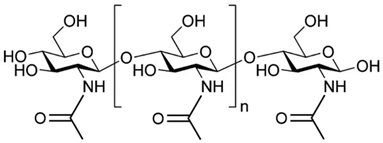
它是节肢动物,如虾、蟹、昆虫外壳的重要成分。甲壳质不溶于水和一般的有机溶剂,在碱溶液中可以脱去乙酰基,生成以氨基葡萄糖为单体的高聚物——壳聚糖(继续水解的产物是α-氨基葡萄糖)。
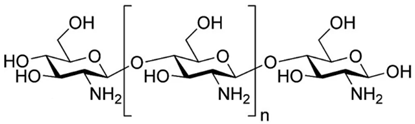
8、组成人体内蛋白质的氨基酸有21种。其中有8种氨基酸在人体内不能合成,必须通过食物供给,这些氨基酸称为必需氨基酸。
9、血红蛋白分子中的谷氨酸会因遗传因素变成缬氨酸,这一微小差别会导致红细胞的形态由正常的圆饼状变为异常的镰刀状,使人患镰状细胞贫血。
10、蛋白质含量的测定:1g氮元素大致相当于6.25g蛋白质,通过测定样品中氮元素的质量分数计算出其中蛋白质的含量。
11、人工合成结晶牛胰岛素:胰岛素是最先被确定氨基酸序列的蛋白质,其结构由英国生物化学家桑格等于1955年测定。它由两条肽链组成,分别是由21个氨基酸形成的A链和30个氨基酸形成的B链,两条链通过二硫键(-S-S-)连接。
中国科学家在1965年首先合成了结晶牛胰岛素。
12、烫发的原理:头发主要由角蛋白组成,其中的含硫氨基酸形成的二硫键(—S—S—)是维持头发弹性和形状的一个重要结构。一般烫发时使用的还原剂可以使头发中的二硫键断裂,产生游离的巯基(—SH)。再用一定的工具将头发卷曲或拉直成需要的形状。然后用氧化剂使巯基之间发生反应,生成新的二硫键,使头发的形状得以固定。
13、松花蛋的制作方法
(1)原料:生石灰、纯碱、柴草灰(含有碳酸钾、氧化钙、氧化钾)、食盐、红茶叶、水、以及米糠、稻壳等。
(2)制法:将纯碱和食盐加水溶解后,再加入生石灰和柴草灰,配成料灰。把料灰(加入一些稻壳或麦糠)均匀涂在鸡蛋上,经过大约两个月,松花蛋制成。
(3)皮蛋制作中的化学原理
首先,生石灰的主要成分是氧化钙,它遇水后就会转化成熟石灰——氢氧化钙:
CaO+H2O=Ca(OH)2
然后,氢氧化钙与纯碱、碳酸钾在溶液中反应:
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+K2CO3=CaCO3↓+2KOH
灰料中的强碱渗透到蛋黄和蛋清中,杀死各种细菌,蛋白中的蛋白质“凝固”与水形成胶冻,同时各种离子和红茶中的鞣质都促使蛋白质凝固和沉淀,使蛋黄凝固和收缩。
14、1981 年,我国科学家采用有机合成与酶促合成相结合的方法,人工合成了具有生物活性的核酸分子——酵母丙氨酸转移核糖核酸。
1999 年,我国参与了人类基因组计划,成为参与该项计划的唯一发展中国家。
2002 年,我国科学家完成了水稻基因组图谱的绘制。
15、聚合酶链反应:聚合酶链反应是一种在生物体外扩增 DNA 片段的重要技术,可使痕量的 DNA 扩增几百万倍。人体毛发、血液和古生物残骸中的痕量 DNA,都能通过这项技术加以扩增,以便在检测后获得相关的生物学信息。自动化 PCR仪可以快速进行核酸检测,应用于传染病、遗传病和恶性肿瘤的诊断,以及司法鉴定和考古研究等领域。
第五章合成高分子
1、高分子的相对分子质量比一般有机化合物大得多,通常在104以上;一般有机化合物的相对分子质量具有明确的数值,而高分子的相对分子质量是一个平均值,因为聚合反应得到的是分子长短不一的混合物。
2、德国化学家施陶丁格于1922年发表论文,提出了“聚合反应是大量小分子以化学键相互结合形成大分子的过程”假说。1953年,施陶丁格获得了诺贝尔化学奖,以表彰他为建立高分子科学作出的贡献。
3、聚四氟乙烯的合成路线如下:
CHCl3+2HF→/SbCl5→CHF2Cl+2HCl
2CHF2Cl→△→CF2=CF2+2HCl
nCF2=CF2→-[-CF2-CF2-]-n
4、高分子材料按用途和性能可分为通用高分子材料(包括塑料、合成纤维、合成橡胶、黏合剂、涂料等)和功能高分子材料(包括高分子分离膜、导电高分子、医用高分子、高吸水性树脂等)等。
5、塑料加工时,为提高柔韧性加入增塑剂,为提高耐热性加入热稳定剂,为赋予它各种漂亮的颜色加入着色剂等。
6、热塑性塑料,可以反复熔融加工,一般为线型结构。
热固性塑料,不能加热熔融,只能一次成型,一般为网状结构。
7、不能用含增塑剂的聚氯乙烯薄膜生产食品包装材料。原因是增塑剂邻苯二甲酸二丁酯等会逐渐逃逸出来,有的增塑剂有毒。
8、高压法聚乙烯和低压法聚乙烯的区别是,高压法聚乙烯有较多支链,较软,软化温度较低,属于低密度聚乙烯(LDPE)。低压法聚乙烯支链较少,较硬,软化温度较高,属于高密度聚乙烯(HDPE)。
9、可降解高分子分为微生物降解和光降解两类高分子材料。
微生物降解高分子有聚乳酸、聚乳酸与淀粉等混合、CO2与环氧丙烷聚合的生物降解塑料等。
光降解高分子有加入光敏剂的聚乙烯等。
10、功能高分子材料:具有某些特殊化学、物理及医学功能的高分子材料。用于化学反应的高分子催化剂,用于分离纯化的各种滤膜,用于信息存储的磁性高分子,用于传感器的形状记忆高分子,用于吸水保水的高吸水性材料,可以替代人体器官、组织的医用高分子材料,用于药物缓释的高分子药物等。
11、海水淡化方法:主要有蒸馏法(包括多级闪蒸、多效蒸发)和反渗透法。现在使用较为高效的分离膜法进行分离。分离膜根据膜孔大小分为微滤膜、超滤膜、纳滤膜和反渗透膜等。
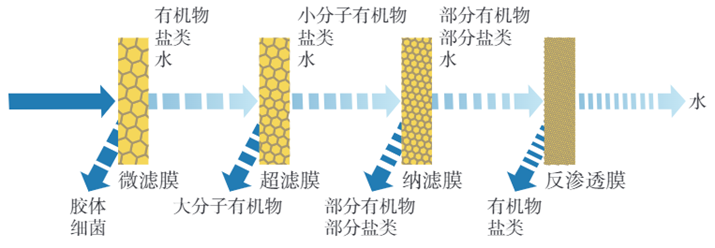
(2)纳滤膜的种类多样,包括但不限于醋酸纤维素、醋酸-三醋酸纤维素、磺化聚砜、磺化聚醚砜、芳香聚酰胺复合材料和无机材料等。
12、硅橡胶由二甲基二氯硅烷[(CH3)2SiCl2]水解得到二甲基硅二醇,经脱水缩聚生成聚硅氧烷,再经交联制成。
化学方程式: (CH3)2SiCl2+2H2O→HOSi(CH3)2OH+2HCl
nHOSi(CH3)2 OH→HO-[-Si(CH3)2O-]n-H+(n-1)H2O
13、维纶是聚乙烯醇缩甲醛纤维的商品名,可用于生产服装、绳索等。合成路线如下
CH2=CH-OOCCH3→-[-CH2-CH(OOCCH3)-]n-→-[-CH2-CHOH-]n-→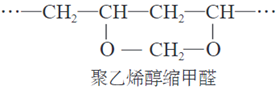
14、ABS树脂是丙烯腈、1,3-丁二烯和苯乙烯三种单体的共聚物,具有耐热、耐腐蚀、强度高等特点,可用于家用电器和仪表的外壳,并可作为3D 打印的材料。
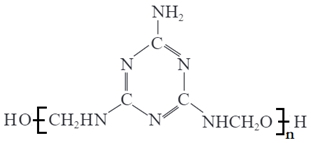
15、仿瓷餐具质轻美观,不易破碎,其主要成分蜜胺树脂是由三聚氰胺与甲醛在一定条件下缩聚得到的网状结构的聚合物。
本套资料word文档下载地址:
https://www.123huaxue.com/hx/2025/13352.html