深挖教材类试题(二)
(选择题1~10题,每小题6分,共60分)
1.新材料的使用体现了化学科技,彰显了中国力量。以下关于合金的说法不正确的是( )
A.通过增加原子层之间的相对滑动难度,使合金的硬度变大
B.不锈钢中添加镍(Ni)和铬(Cr)等元素后,不容易生锈,具有很强的抗腐蚀能力
C.硬铝用于制造飞机外壳,主要利用其熔点高
D.储氢合金属于新型合金,可用于以氢气为燃料的汽车
2.(2024·北京,1)我国科研人员利用激光操控方法,从Ca原子束流中直接俘获41Ca原子,实现了对同位素41Ca的灵敏检测。41Ca的半衰期(放射性元素的原子核有半数发生衰变所需的时间)长达10万年,是14C的17倍,可应用于地球科学与考古学。下列说法正确的是( )

A.41Ca的原子核内有21个中子
B.41Ca的半衰期长,说明41Ca难以失去电子
C.41Ca衰变一半所需的时间小于14C衰变一半所需的时间
D.从Ca原子束流中直接俘获41Ca原子的过程属于化学变化
3.锌锰电池是生活中常用的一种化学电源,酸性锌锰电池和碱性锌锰电池的构造如图所示,下列有关说法错误的是( )
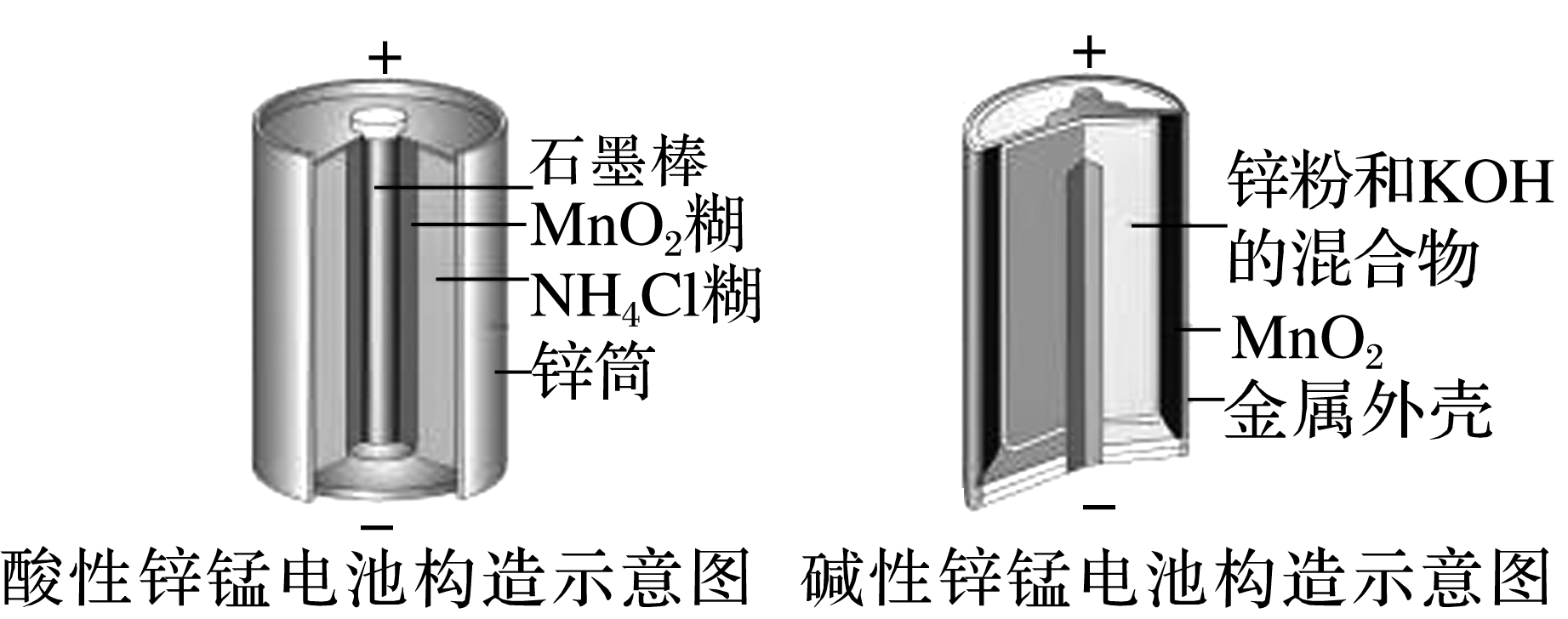
A.二者均属于一次电池
B.二者分别消耗6.5 g锌,都将转移0.2 mol电子
C.二者的正极反应式均为MnO2+H2O+e-===MnO(OH)+OH-
D.碱性锌锰电池比酸性锌锰电池比能量高
4.六氟化硫(SF6)分子形成时,S原子的3s、3p和两个3d轨道参与形成sp3d2杂化,其分子的空间结构呈正八面体形(如图所示)。下列说法正确的是( )
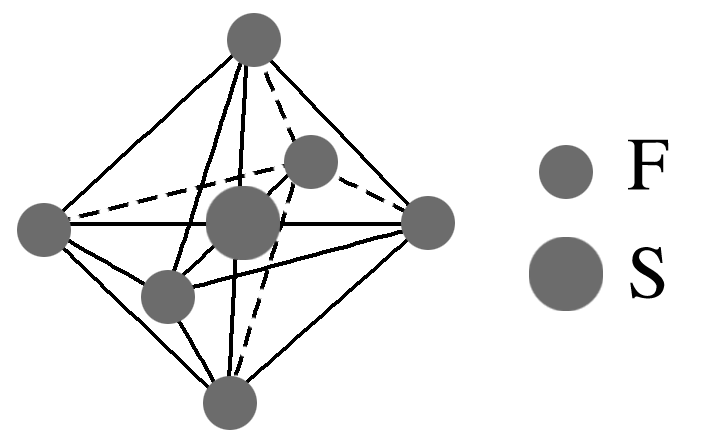
A.SF6分子中S含有孤电子对
B.SF6分子中均为σ键,且键长相等
C.SF6分子中所有的F—S—F的键角均为90°
D.PCl5分子中的P原子也采用sp3d2杂化
5.维生素C具有增强免疫力、促进生长发育、促进伤口愈合等功效,其结构简式如图所示。硝酸银溶液可用于鉴别维生素C,产生黑色沉淀和气体。下列说法正确的是( )
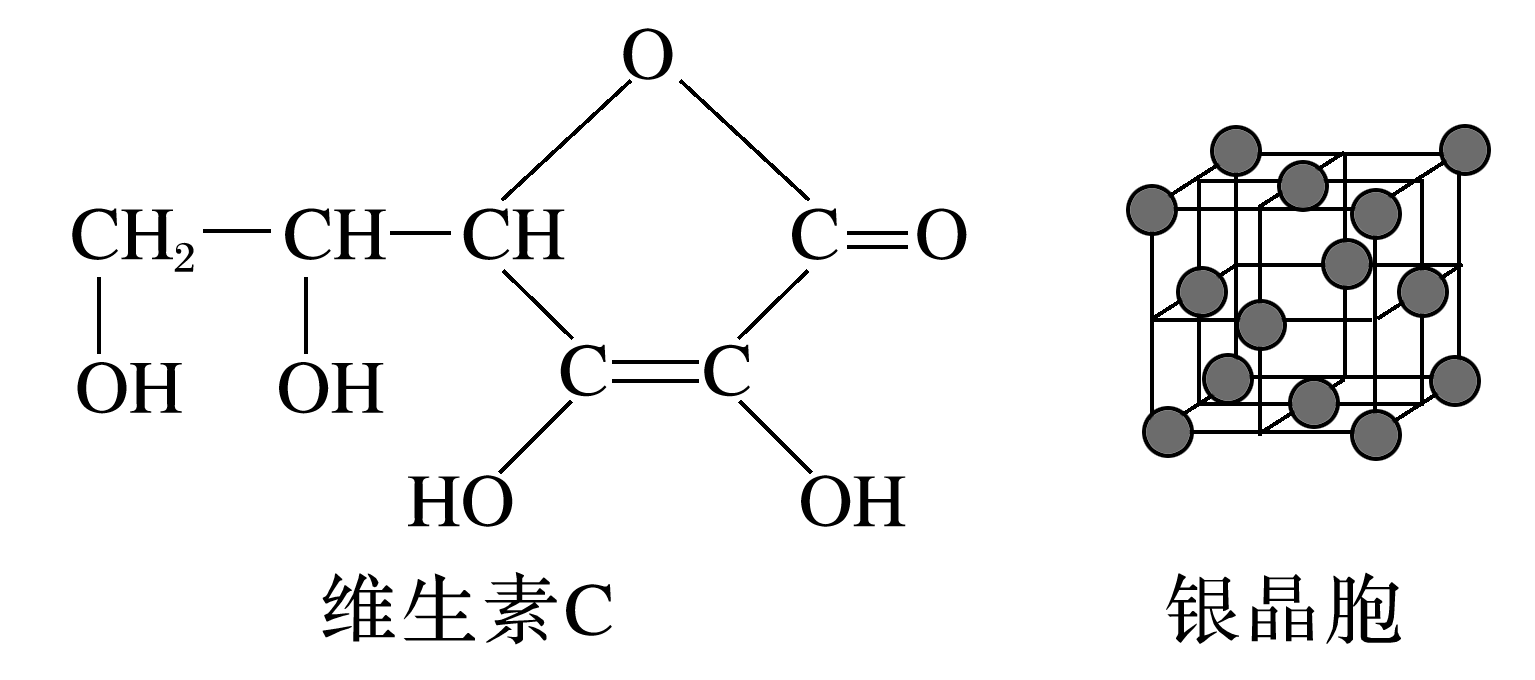
A.维生素C易溶于水是因为其可形成分子内氢键
B.维生素C能发生酯化反应和加成反应
C.维生素C在碱性条件下可稳定存在
D.由银晶胞结构可知,Ag的配位数为6
6.某化学兴趣小组欲利用如图装置设计实验,比较乙酸、碳酸和苯酚的酸性。下列叙述错误的是( )
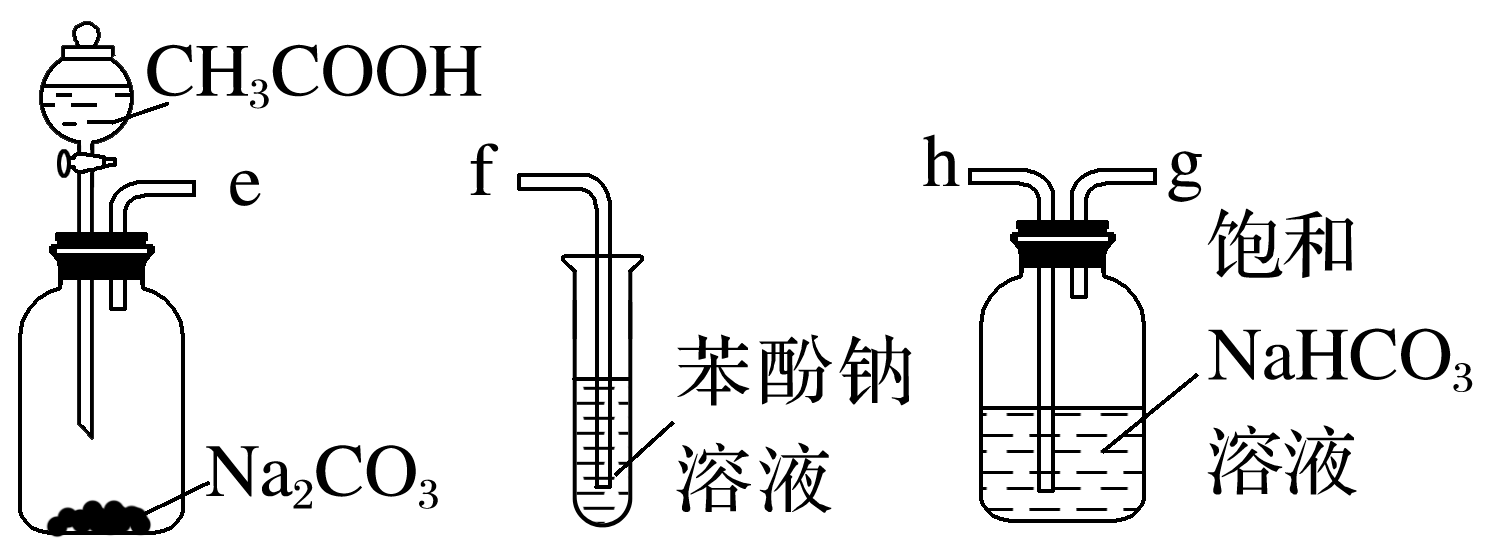
A.导管的连接顺序为ehgf
B.饱和NaHCO3溶液的作用是吸收乙酸
C.试管中发生反应: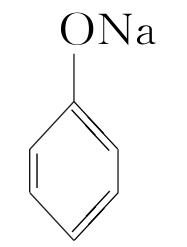 +CO2+H2O―→
+CO2+H2O―→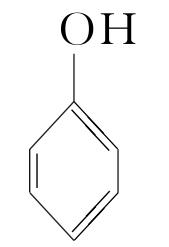 +NaHCO3
+NaHCO3
D.酸性:乙酸>苯酚>碳酸
7 .(2023·北京朝阳区统考模拟)冠醚能与碱金属离子结合(如图1所示),是有机反应很好的催化剂,如能加快KMnO4与环己烯的反应速率。用结合常数表示冠醚与碱金属离子的结合能力,结合常数越大,二者结合能力越强。
.(2023·北京朝阳区统考模拟)冠醚能与碱金属离子结合(如图1所示),是有机反应很好的催化剂,如能加快KMnO4与环己烯的反应速率。用结合常数表示冠醚与碱金属离子的结合能力,结合常数越大,二者结合能力越强。
碱 结合常数 冠醚 | Na+ (直径:204 pm) | K+ (直径:276 pm) |
冠醚A(空腔直径:260~320 pm) | 199 | 1 183 |
冠醚B(空腔直径:170~220 pm) | 371 | 312 |
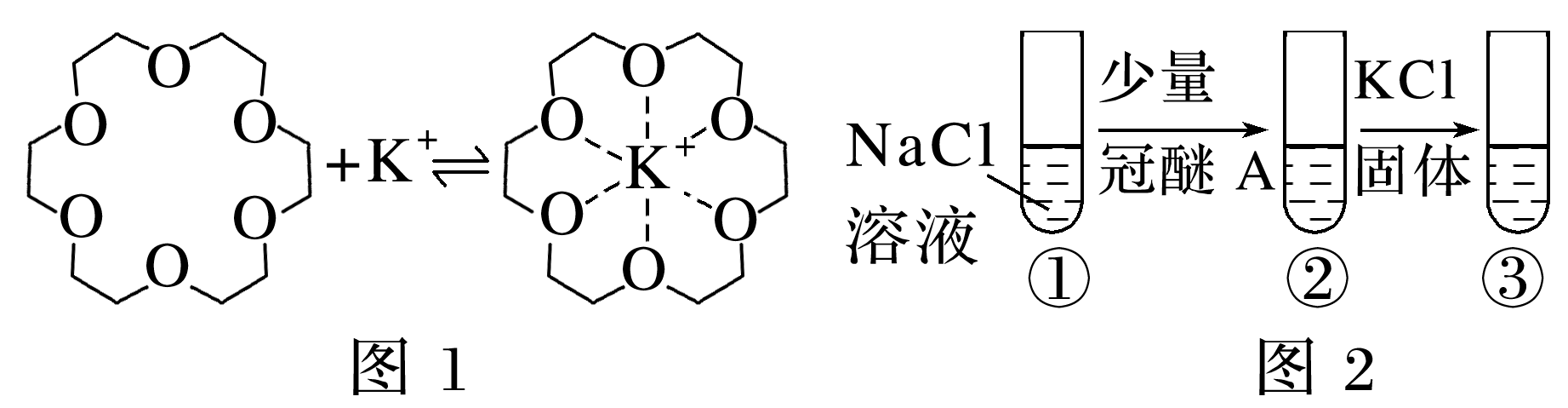
下列说法不正确的是( )
A.推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关
B.如图2所示的实验中c(Na+):①>②>③
C.冠醚通过与K+结合将Mn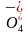 携带进入有机相,从而加快反应速率
携带进入有机相,从而加快反应速率
D.为加快KMnO4与环己烯的反应速率,选择冠醚A比冠醚B更合适
8.(2023·湖南株洲模拟)氧化铍(BeO)在航天航空等领域有着广泛的应用。一种以预处理后的硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等)为原料提取BeO的流程如图所示。
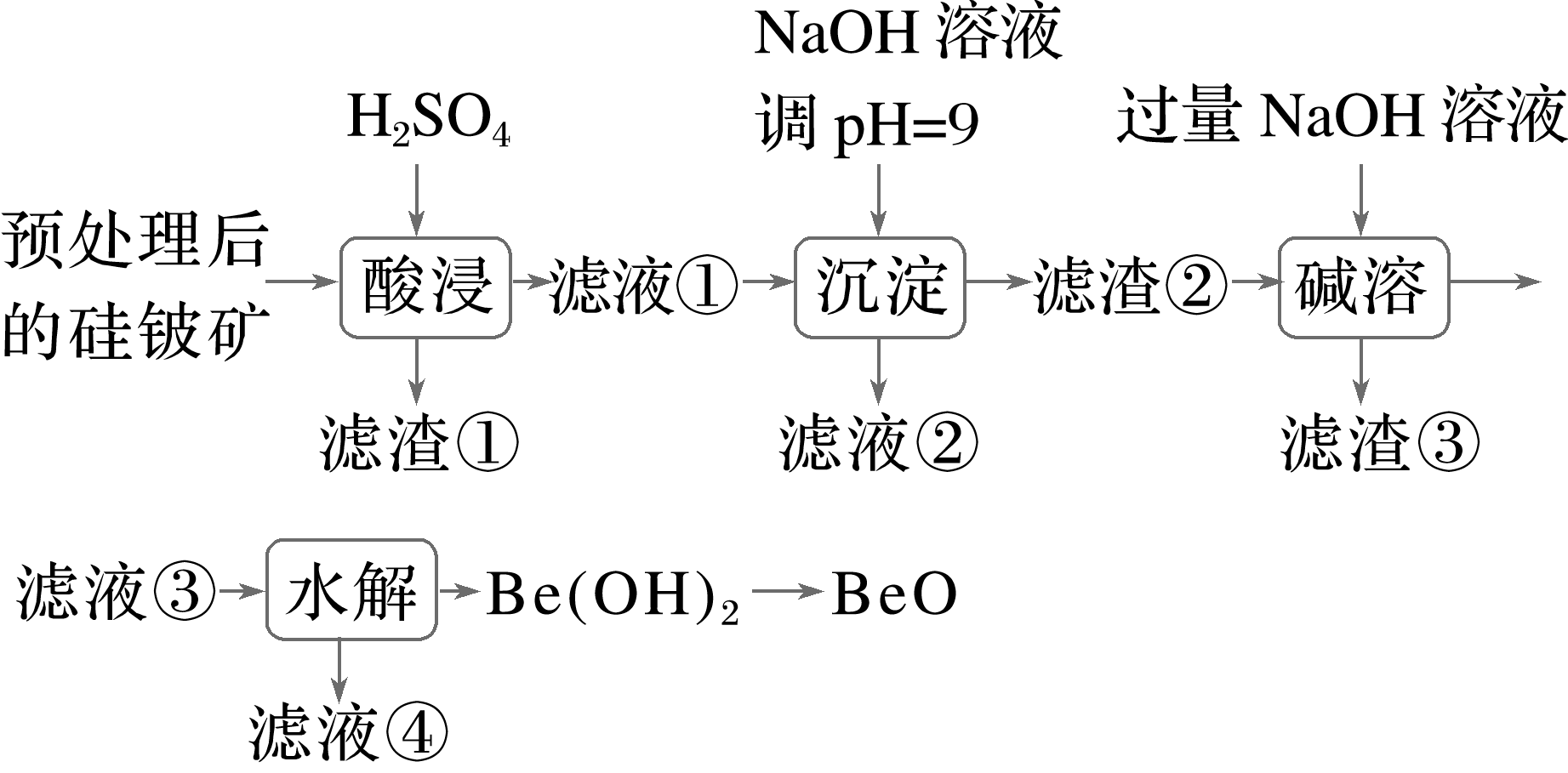
已知:Be(OH)2具有两性,在强碱性溶液中可转化为[Be(OH)4]2-。下列说法错误的是( )
A.“酸浸”步骤所得滤渣①的主要成分为SiO2
B.滤液②经处理后可获得副产品Na2SO4·10H2O
C.“碱溶”时,主要反应为Be(OH)2+2OH-===[Be(OH)4]2-
D.“水解”时,适当增大溶液pH有利于提高BeO的提取率
9.过氧化钠具有强氧化性,常温下能与空气中的二氧化碳、水蒸气反应。某化学兴趣小组设计实验(装置如图所示)探究过氧化钠能否与干燥的二氧化碳反应。下列说法错误的是( )
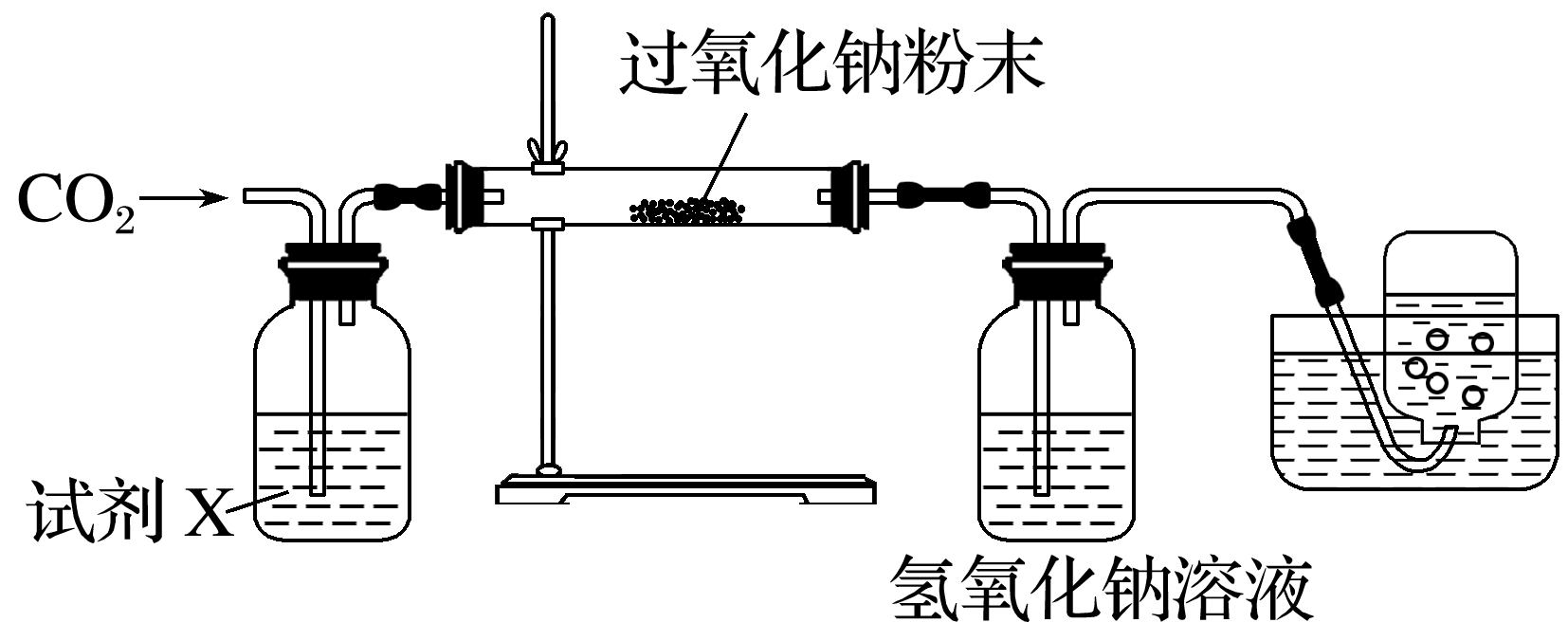
A.若试剂X为碳酸氢钠溶液,可看到过氧化钠粉末变白,集气瓶中收集到无色气体
B.若试剂X为浓硫酸,集气瓶中未收集到气体,说明过氧化钠与干燥的二氧化碳不反应
C.可以用带火星的木条检测收集的气体是否是氧气
D.为了防止引入其他气体,实验时应选用大理石与稀硫酸反应制取二氧化碳
10.(2024·石家庄期末)学习了酸碱中和滴定实验后,常温下,某同学在两个相同的特制容器中分别加入20 mL 0.4 mol·L-1Na2CO3溶液和40 mL 0.2 mol·L-1NaHCO3溶液,再分别用0.4 mol·L-1盐酸滴定,利用pH计和压力传感器检测,得到如图曲线。下列说法正确的是( )
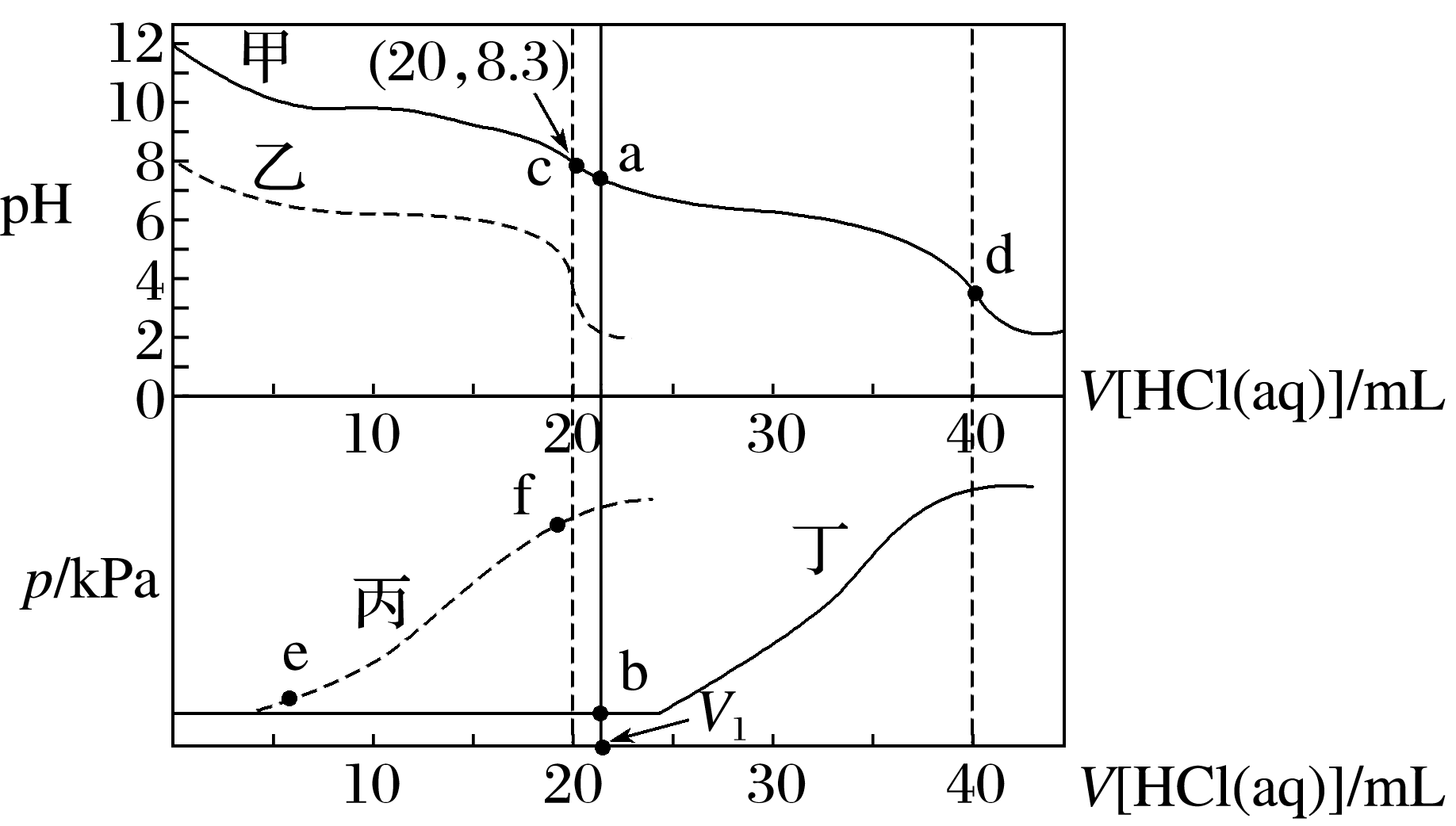
A.水的电离程度:e点
B.当滴加盐酸的体积为V1mL时(a点、b点),所发生的反应用离子方程式表示为HC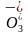 +H+===H2O+CO2↑
+H+===H2O+CO2↑
C.若用与盐酸等物质的量浓度的醋酸溶液滴定,则曲线甲中点位置不变
D.c(20,8.3)点处,c(HC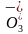 )+2c(H2CO3)+c(H+)=(0.2+10-5.7)
mol·L-1
)+2c(H2CO3)+c(H+)=(0.2+10-5.7)
mol·L-1
11.(22分)合成氨工业发展很快,三位化学家因为合成氨反应获得诺贝尔奖。回答下列问题:
(1)2007年度诺贝尔化学奖获得者格哈德·埃特尔,确认了合成氨反应机理。673 K时,各步反应的能量变化如图,其中吸附在催化剂表面上的粒子用“*”标注。
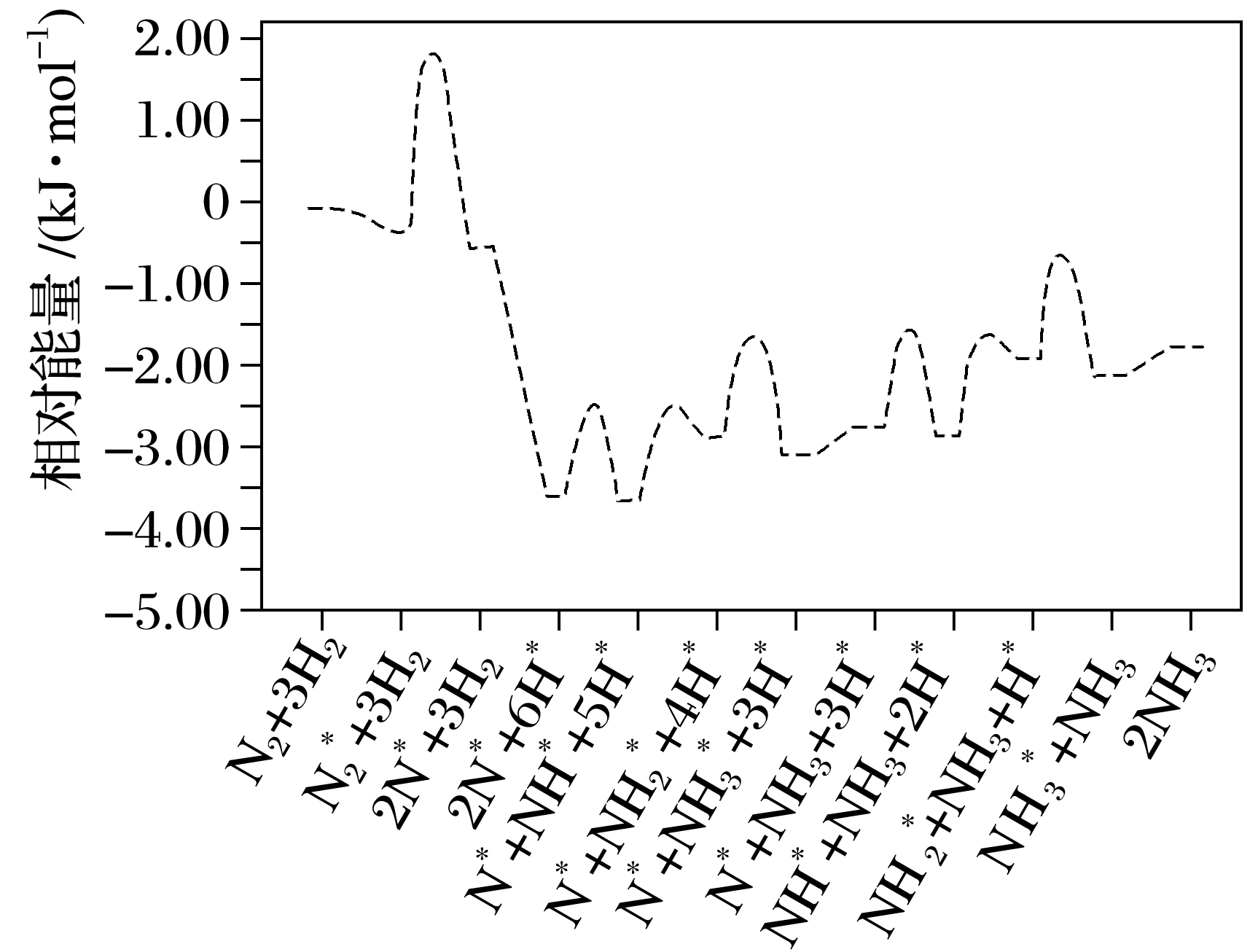
①图中决速步骤的反应方程式为 。
②工业上投料时c(N2)∶c(H2)=1∶2.8,试从化学反应平衡和化学反应速率的角度解释其原因: 。
(2)在催化剂作用下,合成氨的反应速率为v=kcα(N2)·cβ(H2)·cγ(NH3)(k为速率常数,只与温度、催化剂有关,与浓度无关。α、β、γ为反应级数,可取正整数、负整数、0,也可取分数)。 为了测定反应级数,在一定温度下进行实验,其结果如下:
序号 | c(N2)/(mol·L-1) | c(H2)/(mol·L-1) | c(NH3)/(mol·L-1) | 反应速率 |
Ⅰ | 1 | 1 | 1 | v |
Ⅱ | 2 | 1 | 1 | 2v |
Ⅲ | 1 | 4 | 1 | 16v |
Ⅳ | 1 | 4 | 2 | 16v |
①α+β+γ= 。
②已知经验公式为Rlnk=-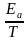 +C(其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度(
+C(其中,Ea、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与温度(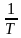 )的关系如图所示。
)的关系如图所示。
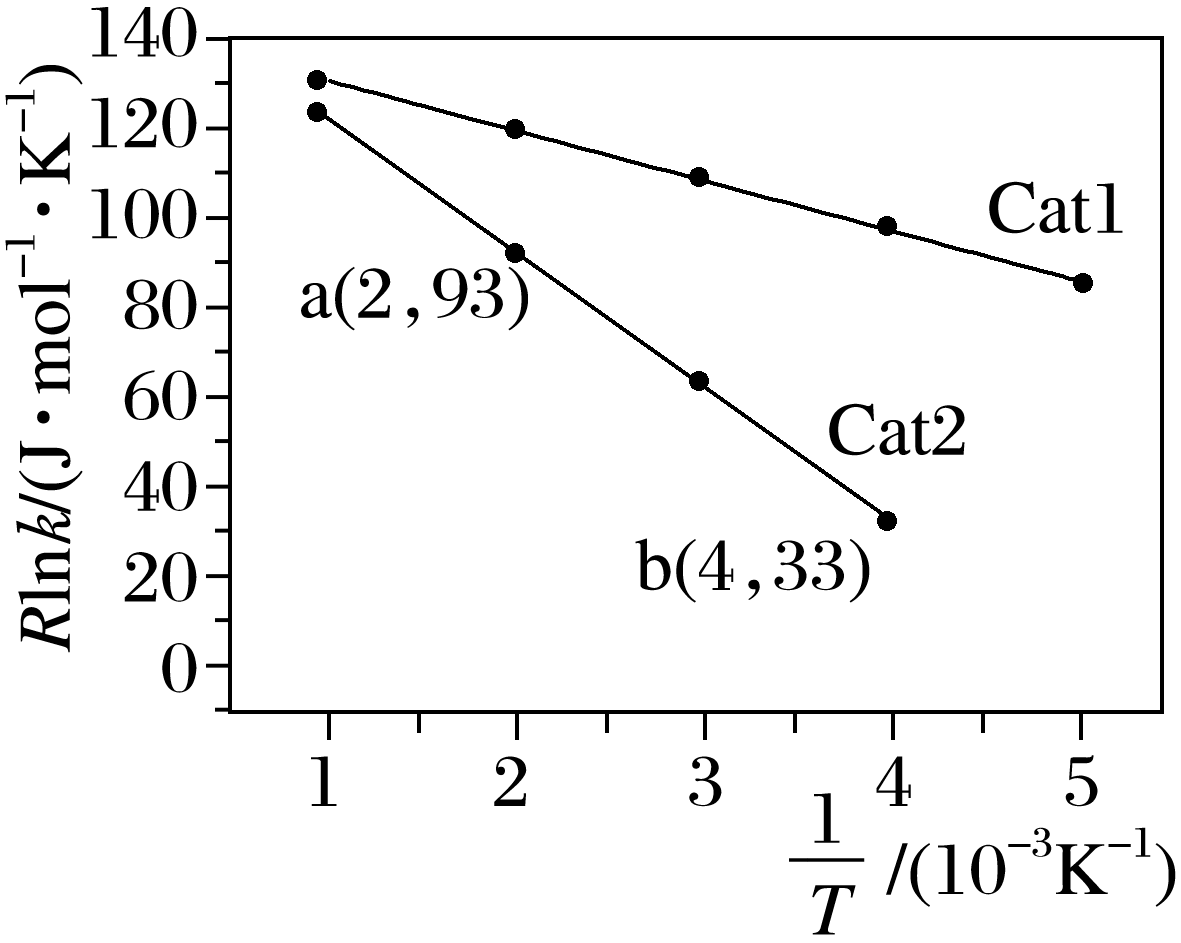
催化效率较高的是 (填“Cat1”或“Cat2”),在Cat2催化剂作用下。活化能Ea为 。
(3)NH3与O2作用分别生成N2、NO、N2O的反应均为放热反应。工业尾气中的NH3可通过催化氧化为N2除去。将一定比例的NH3、O2和N2的混合气体以一定流速经过装有催化剂的反应管,NH3的转化率、N2的选择性[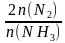 ×100%]与温度的关系如图。
×100%]与温度的关系如图。
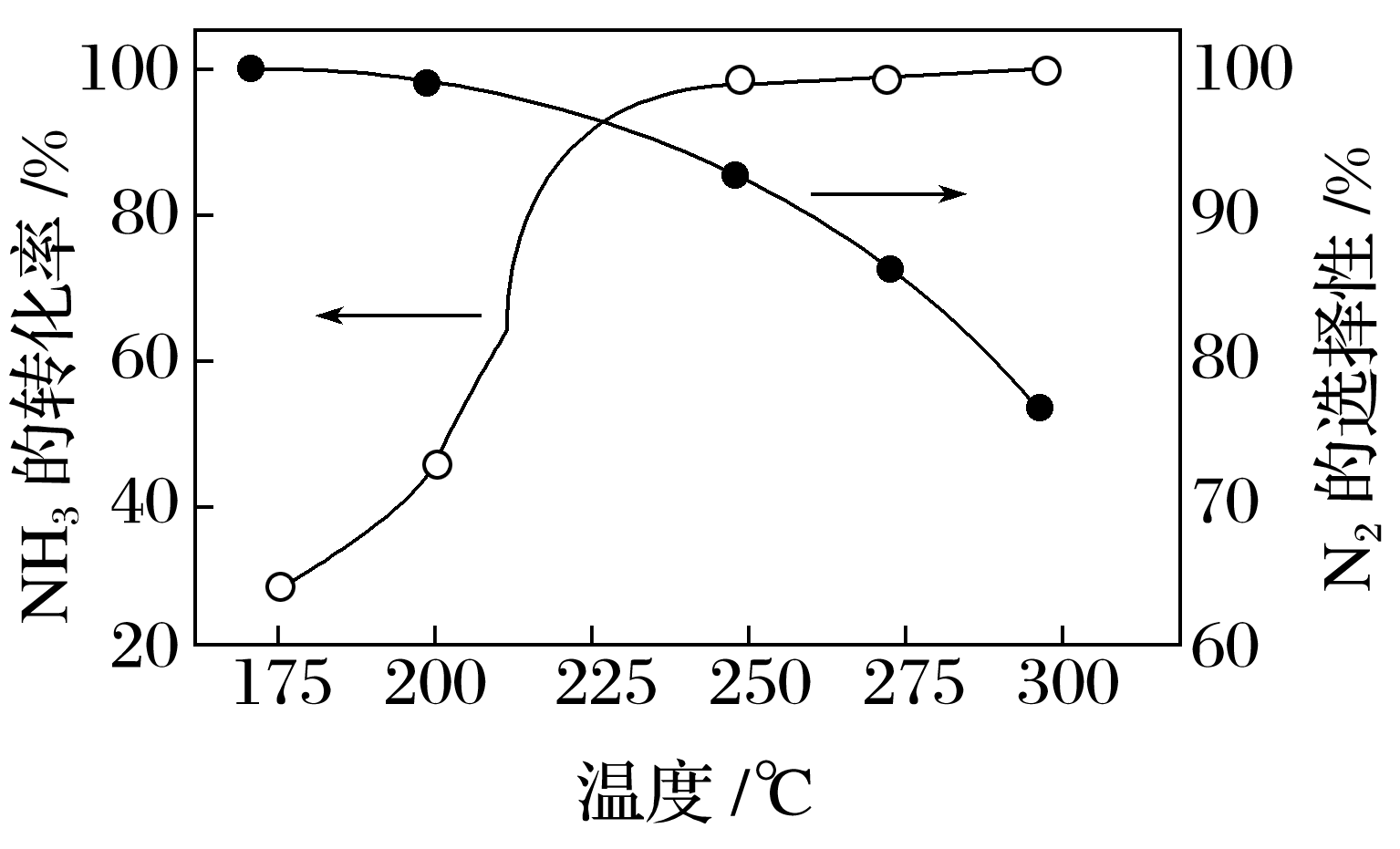
①其他条件不变,在175~300℃范围内升高温度,出口处氮氧化物的量 (填“增大”或“减小”),NH3的平衡转化率 (填“增大”或“减小”)。
②为能更有效除去尾气中的NH3,且使N2的选择性高,应选择的最佳温度为 。
(4)工业合成氨需要的原料之一是H2。国际上最为有效的制氢工艺是甲烷水蒸气重整反应,涉及的主要反应如下:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
反应Ⅱ:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应Ⅲ:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
一定条件下,向恒容容器中以物质的量之比为1∶3的比例投入甲烷和水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则H2的物质的量分数x(H2)= (x=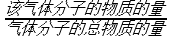 ×100%),反应Ⅲ以物质的量分数表示的平衡常数Kx= (可用分数表示)。
×100%),反应Ⅲ以物质的量分数表示的平衡常数Kx= (可用分数表示)。
(5)利用磷盐分子作为质子导体,可实现高速率电催化还原反应合成NH3,其原理如图所示。
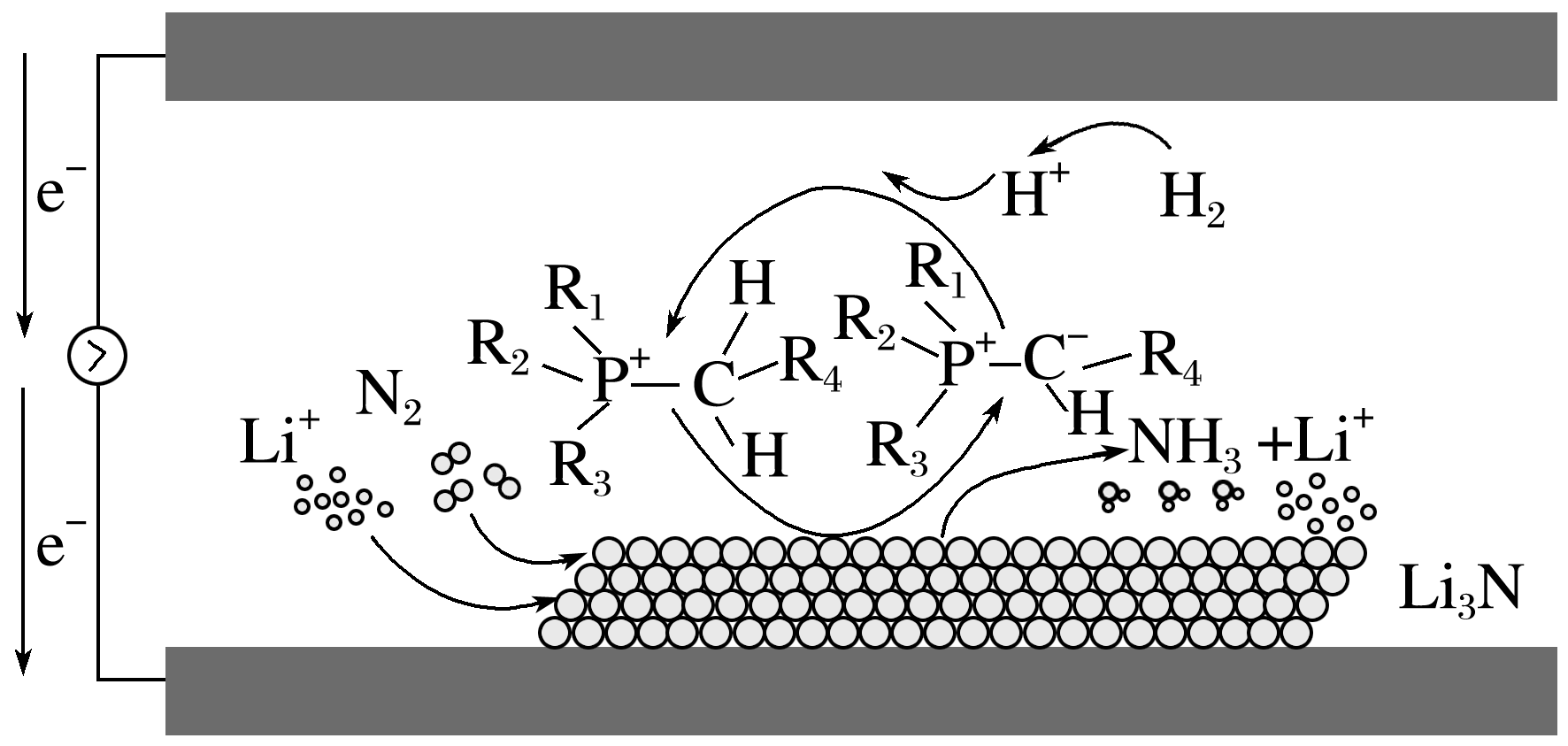
此过程中涉及到生成NH3的反应有 。
12.(18分)(2024·吉林统考模拟)利用木质纤维素为起始原料结合CO2生产聚碳酸对二甲苯酯可以实现碳减排,缓解日益紧张的能源危机,路线如下:
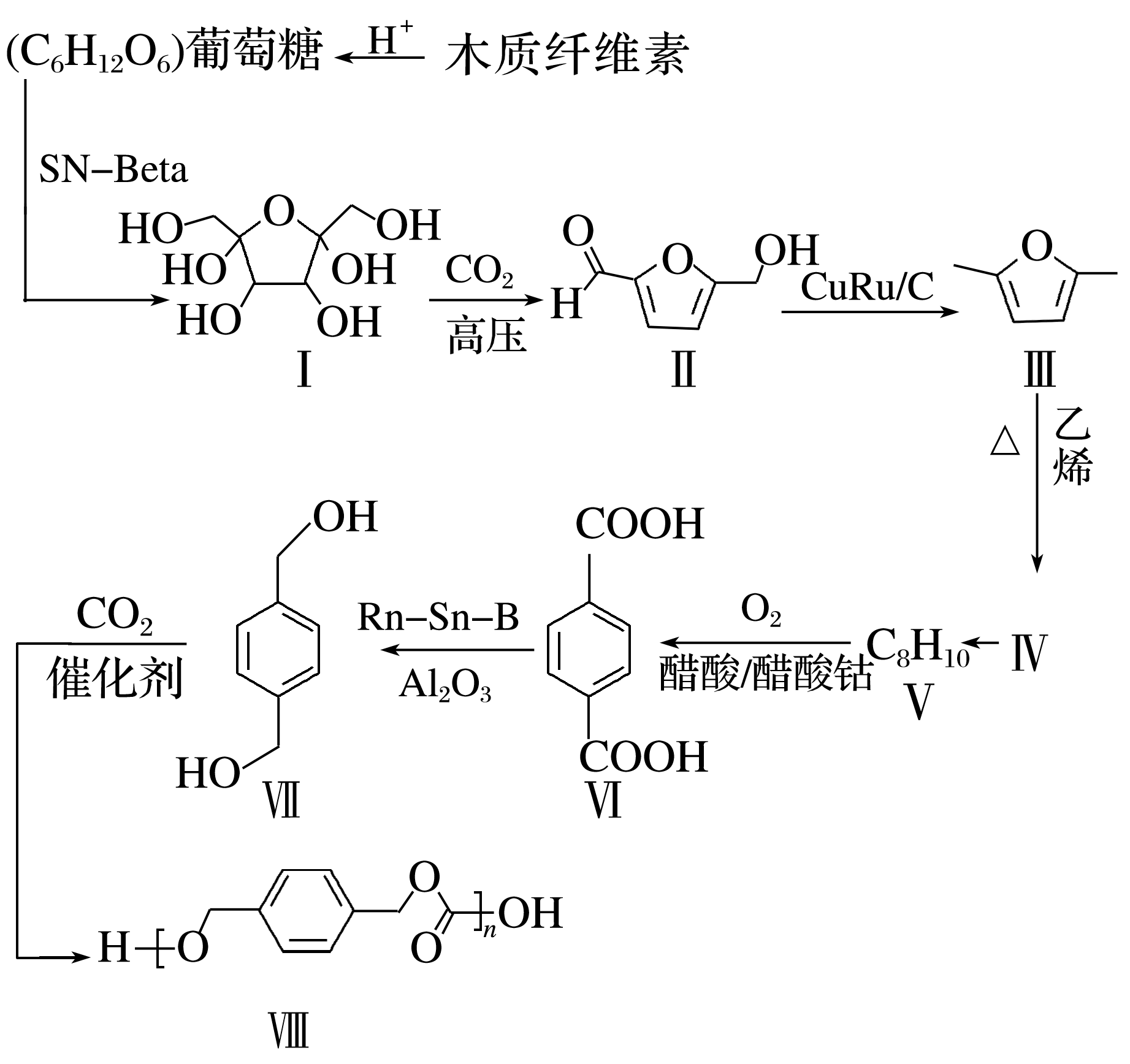
已知:![]()
(1)葡萄糖中含有的官能团有 (写名称)。
(2)化合物Ⅲ中C原子的杂化方式为 。Ⅵ生成Ⅶ的反应类型为 。
(3)1 mol化合物Ⅲ与1 mol乙烯反应得到1 mol Ⅳ,该反应原子利用率为100%,化合物Ⅳ的结构简式为 。
(4)请写出Ⅶ生成Ⅷ的化学方程式: 。
(5)化合物Ⅶ的芳香族同分异构体中符合下列条件的有 种(不含立体异构)。
①最多能与相同物质的量的Na2CO3反应;②能与2倍物质的量的Na反应放出H2。
请写出一种含有等效氢数量最少的同分异构体的结构简式: 。
答案精析
1.C [合金的硬度大于纯金属的硬度,是通过增加原子层之间的相对滑动难度,使合金的硬度变大,A正确;不锈钢中添加镍(Ni)和铬(Cr)等元素后,不容易生锈,具有很强的抗腐蚀能力,B正确;硬铝用于制造飞机外壳,主要利用其密度小、强度高、耐腐蚀性强,C错误。]
2.A [41Ca的质量数为41,质子数为20,中子数为41-20=21,A正确;41Ca的半衰期长短与得失电子能力没有关系,B错误;由题给信息可知,41Ca衰变一半所需的时间大于14C衰变一半所需的时间,C错误;从Ca原子束流中直接俘获41Ca原子的过程没有新物质产生,不属于化学变化,D错误。]
3.C [二者的负极皆为Zn,负极锌失电子,所以二者分别消耗6.5g锌,都将转移0.2mol电子,故B正确;酸性锌锰电池的正极反应式为MnO2+N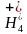 +e-===MnO(OH)+NH3,碱性锌锰电池的正极反应式为MnO2+H2O+e-===MnO(OH)+OH-,故C错误;碱性锌锰电池用锌粉代替锌筒,增大反应物接触面积,加快反应速率,因此碱性锌锰电池比酸性锌锰电池比能量高,故D正确。]
+e-===MnO(OH)+NH3,碱性锌锰电池的正极反应式为MnO2+H2O+e-===MnO(OH)+OH-,故C错误;碱性锌锰电池用锌粉代替锌筒,增大反应物接触面积,加快反应速率,因此碱性锌锰电池比酸性锌锰电池比能量高,故D正确。]
4.B [由图可知,SF6分子的中心原子S形成6个σ键,不含孤电子对,A错误;由图可知,SF6分子只形成σ键,且其呈正八面体形,故键长相等,B正确;SF6分子中有三个F—S—F的键角为180°,C错误;PCl5分子中的P原子的价层电子对数为5,采用sp3d杂化,D错误。]
5.B [维生素C易溶于水是因为其为极性分子,同时其结构中含有多个羟基,可与水形成分子间氢键,A错误;维生素C分子中含有羟基和碳碳双键,能发生酯化反应和加成反应,B正确;维生素C分子中含有酯基,在碱性条件下完全水解,因此维生素C在碱性条件下不稳定,C错误;银晶胞属于面心立方最密堆积,每个Ag的配位数是12,D错误。]
6.D [CH3COOH与Na2CO3发生反应:2CH3COOH+Na2CO3―→2CH3COONa+H2O+CO2↑,乙酸具有挥发性,生成的CO2中混有乙酸蒸气,为防止乙酸对碳酸与苯酚酸性比较实验的干扰,应先用饱和NaHCO3溶液吸收乙酸,结合洗气装置中气体“长进短出”可知,导管的连接顺序为ehgf,A、B正确;试管中发生反应:![]() ―→
―→![]() ,C正确;结合强酸制弱酸原理可知,酸性:乙酸>碳酸>苯酚,D错误。]
,C正确;结合强酸制弱酸原理可知,酸性:乙酸>碳酸>苯酚,D错误。]
7.B [由表中数据可知,同一碱金属离子在冠醚空腔直径大小不同时其结合常数不同,同一冠醚与不同碱金属离子结合时其结合常数也不同,因此可推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关,A正确;冠醚A与K+结合常数大,结合能力强,因此加入KCl固体后,与冠醚A结合的Na+被K+替代,Na+被释放,因此溶液中c(Na+):③>②,B错误;冠醚通过与K+结合将Mn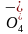 携带进入有机相,增大Mn
携带进入有机相,增大Mn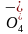 与环己烯的接触面积,从而加快反应速率,C正确;K+适配冠醚A,结合常数大,结合能力强,选择冠醚A比冠醚B更合适,D正确。]
与环己烯的接触面积,从而加快反应速率,C正确;K+适配冠醚A,结合常数大,结合能力强,选择冠醚A比冠醚B更合适,D正确。]
8.D [二氧化硅不溶于稀硫酸,因此“酸浸”步骤所得滤渣①的主要成分为SiO2,故A正确;滤液①中含有的离子主要有H+、Be2+、Fe3+、Fe2+和S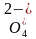 ,加入氢氧化钠溶液将pH调节至9,氢离子被中和,Be2+、Fe3+、Fe2+转化为金属氢氧化物沉淀,滤液为硫酸钠溶液,因此滤液②经处理后可获得副产品Na2SO4·10H2O,故B正确;Fe(OH)2和Fe(OH)3属于碱,Be(OH)2属于两性化合物,“碱溶”时只有氢氧化铍溶解在氢氧化钠溶液中,反应的离子方程式为Be(OH)2+2OH-===[Be(OH)4]2-,故C正确;滤液③中的阴离子主要是[Be(OH)4]2-,其发生水解的离子方程式为[Be(OH)4]2-
,加入氢氧化钠溶液将pH调节至9,氢离子被中和,Be2+、Fe3+、Fe2+转化为金属氢氧化物沉淀,滤液为硫酸钠溶液,因此滤液②经处理后可获得副产品Na2SO4·10H2O,故B正确;Fe(OH)2和Fe(OH)3属于碱,Be(OH)2属于两性化合物,“碱溶”时只有氢氧化铍溶解在氢氧化钠溶液中,反应的离子方程式为Be(OH)2+2OH-===[Be(OH)4]2-,故C正确;滤液③中的阴离子主要是[Be(OH)4]2-,其发生水解的离子方程式为[Be(OH)4]2-![]() Be(OH)2+2OH-,增大溶液的pH,平衡向左移动,不利于生成Be(OH)2,BeO的提取率降低,故D错误。]
Be(OH)2+2OH-,增大溶液的pH,平衡向左移动,不利于生成Be(OH)2,BeO的提取率降低,故D错误。]
9.D [若试剂X为碳酸氢钠溶液,二氧化碳气体中含有水蒸气,能够与过氧化钠反应生成O2,可看到过氧化钠粉末变白,集气瓶中收集到无色气体,A正确;若试剂X是浓硫酸,集气瓶中未收集到气体,说明干燥的CO2没有与Na2O2反应生成O2,B正确;检测氧气可以用带火星的木条,C正确;大理石与稀硫酸反应生成的硫酸钙是微溶物,会覆盖在大理石表面,阻碍反应继续进行,D错误。]
10.D [图中甲、丁线表示向Na2CO3溶液中滴加盐酸;乙、丙线表示向NaHCO3溶液中滴加盐酸,图中丙线表示向NaHCO3溶液中滴加盐酸,NaHCO3+HCl===NaCl+CO2↑+H2O,e点刚开始加入盐酸,则含有的溶质为NaCl和NaHCO3(较多),f点时加入盐酸接近20mL,说明反应几乎完成,则含有的溶质为NaCl和NaHCO3(极少),酸碱抑制水的电离,盐的水解促进水的电离,据此可知水的电离程度:e点>f点,A错误;在加入20mL盐酸时Na2CO3转化成了NaHCO3,从20mL以后发生NaHCO3与HCl反应,由题图可知,b点压强未增大,可知开始时生成的碳酸由于浓度低而没有分解为CO2气体,故当滴加盐酸的体积为V1mL时(a点、b点),所发生反应的离子方程式为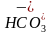 +H+===H2CO3,B错误;若用与盐酸等物质的量浓度的醋酸溶液滴定,则Na2CO3+CH3COOH===CH3COONa+NaHCO3,NaHCO3+CH3OOH===CH3COONa+CO2↑+H2O,反应中生成的CH3COONa水解为碱性,因此曲线甲中点位置会变化,C错误;c(20,8.3)点处,溶液为等浓度NaCl和NaHCO3,电荷守恒①c(Na+)+c(H+)=c(OH-)+c(
+H+===H2CO3,B错误;若用与盐酸等物质的量浓度的醋酸溶液滴定,则Na2CO3+CH3COOH===CH3COONa+NaHCO3,NaHCO3+CH3OOH===CH3COONa+CO2↑+H2O,反应中生成的CH3COONa水解为碱性,因此曲线甲中点位置会变化,C错误;c(20,8.3)点处,溶液为等浓度NaCl和NaHCO3,电荷守恒①c(Na+)+c(H+)=c(OH-)+c(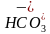 )+2c(
)+2c(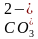 )+c(Cl-),元素守恒②c(Na+)=2c(
)+c(Cl-),元素守恒②c(Na+)=2c(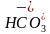 )+2c(
)+2c(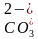 )+2c(H2CO3),①-②得c(H+)+c(
)+2c(H2CO3),①-②得c(H+)+c(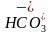 )+2c(H2CO3)=c(OH-)+c(Cl-),pH=8.3时,c(H+)=10-8.3mol·L-1,c(OH-)=
)+2c(H2CO3)=c(OH-)+c(Cl-),pH=8.3时,c(H+)=10-8.3mol·L-1,c(OH-)=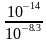 mol·L-1=10-5.7mol·L-1,c(Cl-)=
mol·L-1=10-5.7mol·L-1,c(Cl-)=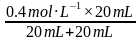 =0.2mol·L-1,故c(H+)+c(
=0.2mol·L-1,故c(H+)+c(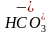 )+2c(H2CO3)=c(OH-)+c(Cl-)=(0.2+10-5.7)mol·L-1,D正确。]
)+2c(H2CO3)=c(OH-)+c(Cl-)=(0.2+10-5.7)mol·L-1,D正确。]
11.(1)①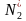 ===2N* ②提高N2的浓度可提高H2的转化率;N2在催化剂上的吸附分解为总反应的决速步骤,适当提高氮气的比例,能加快合成氨反应的进行
===2N* ②提高N2的浓度可提高H2的转化率;N2在催化剂上的吸附分解为总反应的决速步骤,适当提高氮气的比例,能加快合成氨反应的进行
(2)①3 ②Cat1 30.0 kJ·mol-1
(3)①增大 减小 ②225℃ (4)50% 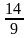
(5)N2+6e-+6H+===2NH3、Li3N+3H+===NH3↑+3Li+
解析 (1)①图中决速步骤是反应速率最小即活化能最大的一步,读图可知反应方程式: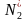 ===2N*。
===2N*。
②根据工业合成氨反应可知反应比为c(N2)∶c(H2)=1∶3,而工业上投料时c(N2)∶c(H2)=1∶2.8,对比分析可知:提高N2的浓度可提高H2的转化率;N2在催化剂上的吸附分解为总反应的决速步骤,适当提高氮气的比例,能加快合成氨反应的进行。
(2)①将各组数据代入计算,将Ⅰ、Ⅱ组数据代入,α为1;将Ⅰ、Ⅲ组数据代入,β为2;将Ⅲ、Ⅳ组数据代入,γ为0;所以α+β+γ=3。
②根据经验公式可知,温度变化相同时,Rlnk变化值与活化能成比例,活化能越大,变化值越大。故斜率越小,活化能越小,催化剂Cat1催化效率较高,代入a、b点数据可知,93=-Ea×2×10-3+C,33=-Ea×4×10-3+C,解得Ea=30.0kJ·mol-1。
(3)①其他条件不变,在175~300℃范围内升高温度,由图可知NH3的转化率逐渐增大,而N2的选择性逐渐减小,所以出口处氮氧化物的量增大;由题意可知该反应为放热反应,升高温度平衡逆向移动,所以NH3的平衡转化率减小。
②为能更有效除去尾气中的NH3,应使NH3的转化率尽可能大,且使N2的选择性高,所以应选择的最佳温度为图中交点,即225℃。
(4)假设开始时甲烷和水蒸气的物质的量分别为1mol和3mol,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则甲烷剩余1mol×(1-80%)=0.2mol,水蒸气剩余3mol×(1-40%)=1.8mol,根据H原子守恒可知所得H2的物质的量是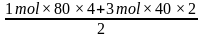 =2.8mol,根据C原子和O原子守恒可得n(CO)=n(CO2)=0.4mol,所以平衡时n(总)=5.6mol,则H2的物质的量分数x(H2)=
=2.8mol,根据C原子和O原子守恒可得n(CO)=n(CO2)=0.4mol,所以平衡时n(总)=5.6mol,则H2的物质的量分数x(H2)=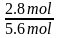 ×100%=50%,反应Ⅲ以物质的量分数表示的平衡常数Kx=
×100%=50%,反应Ⅲ以物质的量分数表示的平衡常数Kx=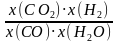 =
=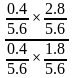 =
=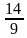 。
。
12.(1)羟基、醛基 (2)sp2、sp3 还原反应
(3)![]()
(4)n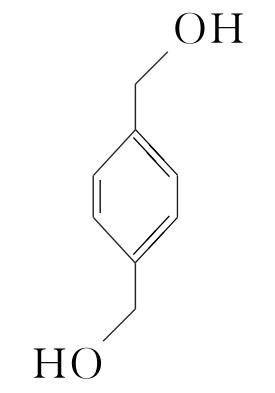 +nCO2
+nCO2![]()
![]() +(n-1)H2O
+(n-1)H2O
(5)16 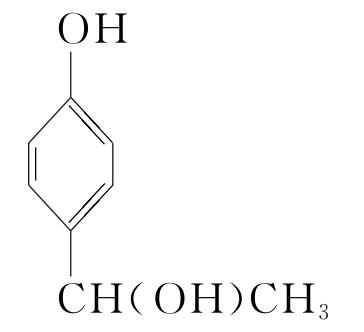 (或
(或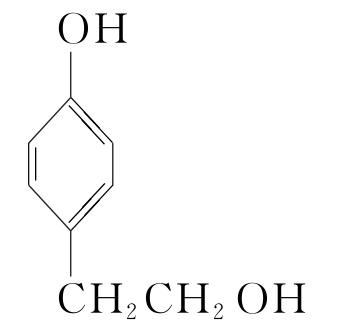 )
)
解析 (2)由题干流程图中化合物Ⅲ的结构简式可知,化合物Ⅲ中C原子的杂化方式为sp2和sp3;Ⅵ生成Ⅶ即为羧基转变为羟基,根据有机反应中加氢失氧为还原反应可知,该反应类型为还原反应。(3)1mol化合物Ⅲ与1mol乙烯反应得到1molⅣ,该反应原子利用率为100%,化合物Ⅳ的结构简式为![]() 。
。
(4)Ⅶ和CO2发生缩聚反应生成Ⅷ,则Ⅶ生成Ⅷ的化学方程式为n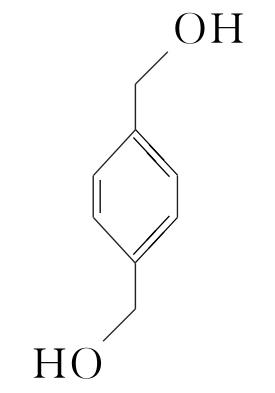 +nCO2
+nCO2![]()
![]() +(n-1)H2O。(5)化合物Ⅶ的芳香族同分异构体中符合下列条件:①最多能与相同物质的量的Na2CO3反应;②能与2倍物质的量的Na反应放出H2,说明含有1个酚羟基和1个醇羟基,如果取代基为—OH、—CH2CH2OH,两个取代基有邻、间、对3种位置结构;如果取代基为—OH、—CH(OH)CH3,两个取代基有邻、间、对3种位置结构;如果取代基为—OH、—CH3、—CH2OH,有10种结构,所以符合条件的同分异构体有16种,根据等效氢原理可知,含有等效氢数量最少的同分异构体的结构简式为
+(n-1)H2O。(5)化合物Ⅶ的芳香族同分异构体中符合下列条件:①最多能与相同物质的量的Na2CO3反应;②能与2倍物质的量的Na反应放出H2,说明含有1个酚羟基和1个醇羟基,如果取代基为—OH、—CH2CH2OH,两个取代基有邻、间、对3种位置结构;如果取代基为—OH、—CH(OH)CH3,两个取代基有邻、间、对3种位置结构;如果取代基为—OH、—CH3、—CH2OH,有10种结构,所以符合条件的同分异构体有16种,根据等效氢原理可知,含有等效氢数量最少的同分异构体的结构简式为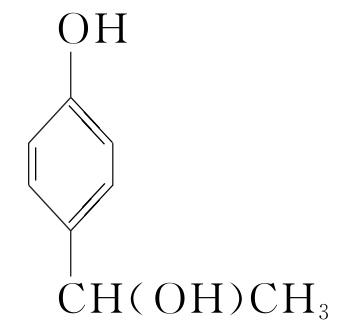 或
或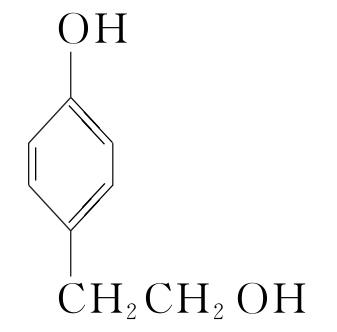 。
。
本套试卷下载地址:https://www.123huaxue.com/hx/2025/11114.html
 金属离子
金属离子