《突破“阿伏加德罗常数”的陷阱》

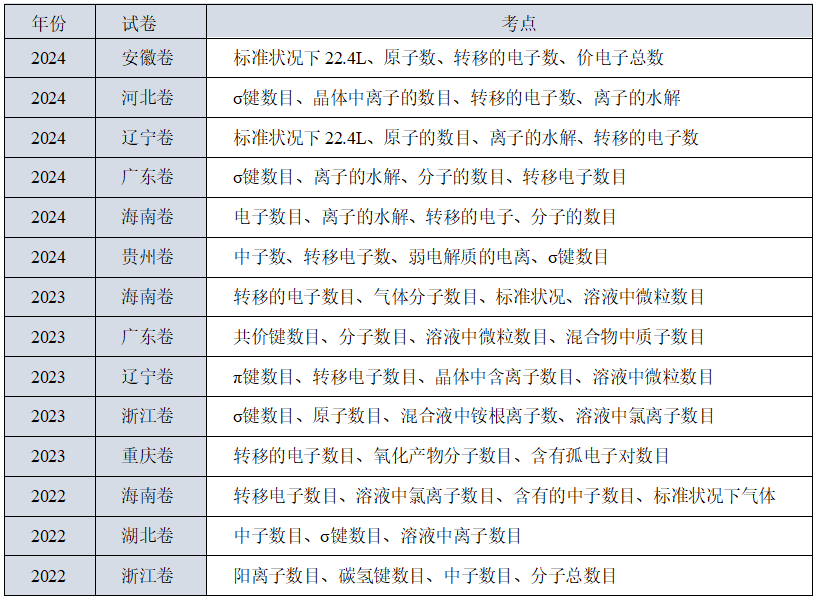

此题型利用阿伏加德罗常数这个载体综合考查相关知识,涉及一定量的物质中所含粒子的数目、氧化还原反应中转移电子的数目以及电解质溶液中的电离、水解平衡及守恒思想等,该题涉及知识范围广,各选项考点独立,形式灵活,具有一定难度。2025高考预测方面,可能会继续考查常见的考点,但情境会更贴近生活或科技前沿。例如,结合最新的电池技术、催化剂研究、药物合成等,让学生计算其中的粒子数目或反应中的电子转移。还需要注意阿伏加德罗常数与其他知识点的结合,比如电化学中的电量计算、热化学中的焓变与物质的量的关系等。这些综合题可能会增加难度,考查学生的知识迁移能力。

1.22.4 L·mol-1的适用条件
标准状况(0 ℃、101 kPa)下气体摩尔体积约为22.4 L·mol-1。
(1)非标准状况下的气体、标准状况下的非气体均不适用22.4 L·mol-1进行物质的量的计算。
(2)标准状况下的非气态物质:H2O、苯、CCl4、CH2Cl2、CHCl3、CH3OH、CH3CH2OH、CH3COOH、溴、HF、NO2、SO3及碳原子数大于4的烃等。
2.物质的组成与结构
(1)稀有气体、臭氧(O3)、白磷(P4)分子中的原子数目。
(2)一定质量含某核素的物质中的质子、中子、电子或原子的数目。
(3)Na2O2、KO2、NaHSO4中的阴、阳离子个数比;注意物质的存在形态不同,离子的种类、数目不同。
(4)等物质的量的羟基与氢氧根离子所含质子、电子或原子的数目。
(5)H2O、D2O、T2O的中子数。
(6)有机物中共价键的数目(苯环中无碳碳双键),如C3H8、CH3OH。
(7)共价化合物中的价键数目,如1 mol SiO2中含Si—O的数目为4NA;1 mol C(金刚石)中含C—C的数目为2NA;1 mol C(石墨)中含C—C的数目为1.5NA;1 mol白磷(P4)中含P—P的数目为6NA;CnH2n+2中共价键数为3n+1;1 mol S8中含S—S的数目为8NA。
(8)含NA个Fe(OH)3的氢氧化铁胶粒数小于NA。
3.可逆过程
(1)可逆反应:
2SO2+O2 2SO3;2NO2
2SO3;2NO2 N2O4;N2+3H2
N2O4;N2+3H2 2NH3;Cl2+H2O
2NH3;Cl2+H2O H++Cl-+HClO;H2+I2
H++Cl-+HClO;H2+I2 2HI;NH3+H2O
2HI;NH3+H2O NH3·H2O等。判断生成分子的数目、反应中转移电子的数目等,要考虑可逆反应不能进行到底。
NH3·H2O等。判断生成分子的数目、反应中转移电子的数目等,要考虑可逆反应不能进行到底。
(2)弱电解质溶液中各微粒的数目和浓度,如CH3COOH、NH3·H2O溶液中分子和离子数目。
(3)能水解的盐溶液中各微粒的数目和浓度,如一定体积、一定浓度的CH3COONa、NH4Cl、FeCl3溶液中各微粒数目。
4.氧化还原反应
(1)歧化反应:NO2与水、Na2O2与CO2、Na2O2与H2O、Cl2与水、Cl2与NaOH溶液(冷稀、浓热)等。
(2)与氧化性强弱有关:变价金属(Fe、Cu)与强、弱氧化剂(Cl2、I2)反应。
(3)与量有关(足量、不足量):Fe与稀硝酸、Fe与浓硫酸反应。
(4)与浓、稀有关:MnO2与浓盐酸反应、Cu与浓H2SO4反应、Cu与浓硝酸反应,均需要考虑浓度的降低对反应的影响,从而判断对转移电子数目的影响。
(5)与氧化还原的顺序有关:如向FeI2溶液中通入Cl2,首先氧化I-,再氧化Fe2+。
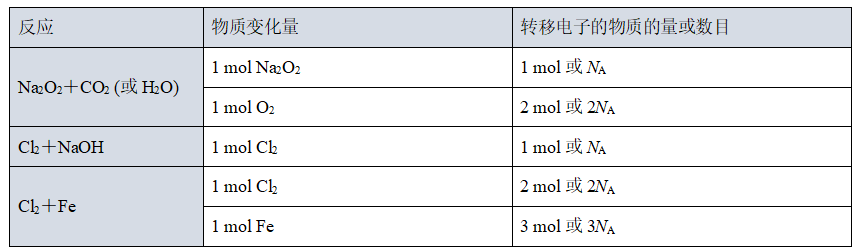
(6)特殊反应中电子转移总数
5.电解质溶液中的粒子数目
(1)溶液中是否存在弱电解质或能水解的“弱离子”,如1 L 1 mol·L-1 的乙酸或1 L 1 mol·L-1 乙酸钠溶液中CH3COO-数目均小于NA。
(2)试题中是否指明了溶液的体积,如在pH=1的HCl溶液中,因溶液体积未知而无法求算H+的数目。
(3)所给条件是否与电解质的组成有关,如pH=1的H2SO4溶液,c(H+)=0.1 mol·L-1,与电解质的组成无关;0.05 mol·L-1的Ba(OH)2溶液,c(OH-)=0.1 mol·L-1,与电解质的组成有关。
本套资料word文档下载地址: