过渡晶体与混合晶体
一、过渡晶体
1.定义:介于典型晶体之间的晶体
2.第3周期元素氧化物的晶体类型不同及其原因:
(1)第三周期元素的氧化物中,化学键中离子键的百分数
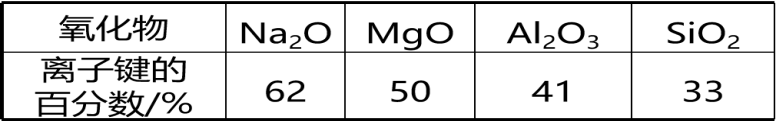
①化学键既不是纯粹的离子键,也不是纯粹的共价键;
②离子键的百分数大于50%,当作离子晶体处理;离子键的百分数小于50%,偏向共价晶体,当作共价晶体处理;
③P2O5、SO3、Cl2O7等离子键成分的百分数更小,共价键不再贯穿整个晶体,作分子晶体处理。
④一般,当电负性的差值△χ>1.7时,离子键的百分数大于50%。可认为是离子晶体。电负性差值越大,离子键的百分数越大。
(2)第3周期元素氧化物的晶体类型

①纯粹的典型晶体不多,大多数晶体是它们之间的过渡晶体。
②一般偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,通常当作离子晶体来处理,如Na2O。
③偏向共价晶体的过渡晶体则当作共价晶体来处理,如Al2O3、SiO2等。
④P2O5、SO3、Cl2O7等则视为分子晶体。
3.规律:
(1)四种典型晶体类型都存在过渡晶体;
(2)晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理。
4.离子键的呈现规律:同周期主族元素从左到右,最高价氧化物中离子键成分的百分数逐渐减小。
二、混合型晶体——石墨
1.概念:晶体内同时存在若干种不同的作用力,具有若干种晶体的结构和性质。
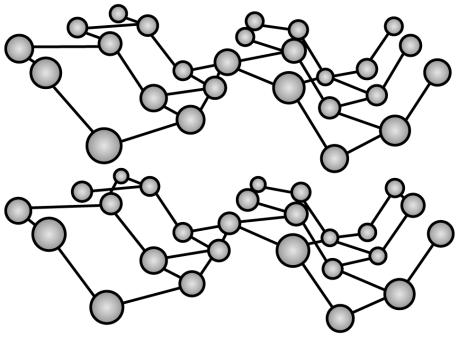
2.石墨晶体结构
(1)晶体模型
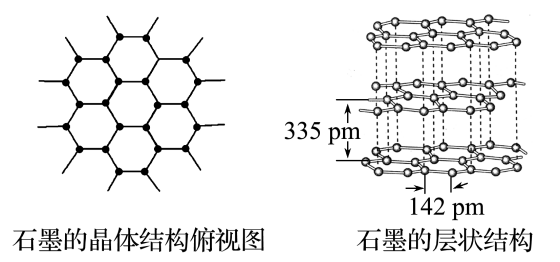
(2)结构特点
①同层内,碳原子采用sp2杂化,以共价键相结合形成正六边形平面网状结构。所有碳原子的p轨道平行且相互重叠,p电子可在整个平面中运动。
②层内的碳原子的核间距为142pm,层间距离为335pm,说明层间没有化学键相连,是靠范德华力维系的。
③最小的环:六元环。石墨中每个碳原子采取sp2杂化,形成3个sp2杂化轨道,分别与相邻的3个碳原子的sp2杂化轨道重叠形成键,6个碳原子在同一平面上形成正六边形的环,伸展形成平面六元并环结构,由于每个碳原子为三个六元环所共用,即每个六元环拥有的碳原子数为6×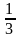 =2,碳碳键为两个六元环所共用,每个六元环拥有的碳碳键数为6×
=2,碳碳键为两个六元环所共用,每个六元环拥有的碳碳键数为6×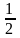 =3,键角为120°。
=3,键角为120°。
④每个碳原子的配位数为3,每个碳原子还有1个与碳环平面垂直的未参与杂化的2p轨道,并含有1个未成对电子,这些2p轨道互相平行,并垂直于碳原子sp2杂化轨道构成的平面。由于所有的p轨道相互平行而且相互重叠,使p轨道中的电子可在整个碳原子平面中运动。因此,石墨有类似金属晶体的导电性,而且,由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面,所以石墨的导电性只能沿石墨平面的方向。
(3)晶体类型:既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
(4)性质:一种结晶形碳,灰黑色,成叶片状、鳞片状和致密块状,熔点很高(层内碳原子之间全部为共价键,共价键能大)、质软(具滑腻感)(原因:层与层之间依靠范德华力结合,范德华力小,层之间易于断开滑动)、易导电(原因:石墨层中每个碳原子未杂化的平行P轨道上的电子形成离域大π键,其电子可在层内运动,成为自由电子)。化学性质不活泼,耐腐蚀,在空气或氧气中强热可以燃烧生成CO2。
(5)石墨用途:石墨可用作润滑剂,可用于制造坩埚、电极、铅笔芯等。
【研究与实践-明矾晶体的制备p93】
1.有关明矾晶体四个知识点:
(1)明矾晶体的化学式为KAI(SO4)2・12H2O或K2SO4·Al2(SO4)3·24H20。
(2)明矾晶体易溶于水。
(3)明矾晶体在水中电离出K+和A13+两种金属阳离子和一种阴离子,它是一种复盐。
(4)明矾晶体在水中发生水解反应生成氢氧化铝胶体,它可用作自来水的净水剂。
2.【结果与讨论】参考答案:
(2)问题一:因为杂质的存在会影响晶体生长的速度和大小。
问题二:晶种悬挂在溶液中央位置,有利于离子对称地扩散、溶角解与结晶,有利于获得外形对称性较好的晶体。如果晶体离烧杯底部太近,由于有沉底晶体生成,会与晶体长在一起,使得晶体形状不规则;若晶种离溶液表面太近,或靠近烧杯壁,都会产生同样的结果。
(3)称取约60g明矾,量取60mL蒸馏水倒入100mL烧杯中,将明矾溶解于水,边搅拌边加热,加热到90℃。选择晶形规则的晶体作得为晶种,用棉线拴住,待溶液温度约下降5一6℃后,再将其吊在上方,使得晶体处于溶液的中心位置。30min后,就会很明显地观象到约有1cm3大小的规则的八面体结构的明矾晶体出现。在此过程中,每隔几分钟,就可以观察到晶体大小的明显变化(此方案仅作参考)。
三、晶体熔、沸点高低的比较
1.不同类型晶体熔、沸点的比较
(1)不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。
(2)金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
2.同种类型晶体熔、沸点的比较
(1)共价晶体
原子半径越小→键长越短→键能越大→熔、沸点越高,如熔点:金刚石>碳化硅>硅。
(2)离子晶体
①一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO>NaCl>CsCl。
②衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔、沸点越高,硬度越大。
(3)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高,如H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2、CH3OH>CH3CH3。
④同分异构体支链越多,熔、沸点越低。如CH3CH2CH2CH2CH3>CH3CH(CH3)CH2CH3>CH3C(CH3)2CH3。
(4)金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高,如熔、沸点:Na<Mg<Al。

►问题一 过渡晶体概念及性质
【典例1】下列说法不正确的是
A.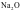 中离子键的百分数为62%,则
中离子键的百分数为62%,则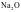 不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.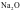 通常当作离子晶体来处理,因为
通常当作离子晶体来处理,因为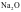 是偏向离子晶体的非过渡晶体,在许多性质上与纯粹的离子晶体接近
是偏向离子晶体的非过渡晶体,在许多性质上与纯粹的离子晶体接近
C.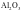 是偏向共价晶体的过渡晶体,当作共价晶体来处理;
是偏向共价晶体的过渡晶体,当作共价晶体来处理;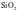 是偏向共价晶体的过渡晶体,当作共价晶体来处理
是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
【答案】B
【解析】A.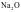 中离子键的百分数为62%,还存在共价键,则
中离子键的百分数为62%,还存在共价键,则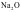 不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体,故A正确;B.
不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体,故A正确;B.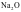 通常当作离子晶体来处理,因为
通常当作离子晶体来处理,因为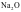 是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,是过渡晶体而不是非过渡晶体,故B错误;C.
是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,是过渡晶体而不是非过渡晶体,故B错误;C.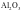 、
、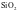 均是偏向共价晶体的过渡晶体,当作共价晶体来处理,故C正确;D.根据微粒间存在的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型;故D正确;故选B。
均是偏向共价晶体的过渡晶体,当作共价晶体来处理,故C正确;D.根据微粒间存在的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型;故D正确;故选B。
【解题必备】①纯粹的典型晶体不多,大多数晶体是它们之间的过渡晶体。
②一般偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,通常当作离子晶体来处理,如Na2O。
③偏向共价晶体的过渡晶体则当作共价晶体来处理,如Al2O3、SiO2等。
④P2O5、SO3、Cl2O7等则视为分子晶体。
【变式1-1】下列晶体中属于共价型过渡晶体的是
A.Al2O3 B.Na2O C.NaOH D.石墨
【答案】A
【解析】A.Al2O3是离子晶体与共价晶体之间的过渡晶体,偏向共价晶体,可当作共价晶体处理,A符合题意;B.Na2O是离子晶体与共价晶体之间的过渡晶体,偏向离子晶体,B不符合题意;C.NaOH属于离子键构成的离子晶体,C不符合题意;D.石墨是混合型晶体,不属于共价型过渡晶体,D不符合题意;故选A。
【变式1-2】下列关于过渡晶体的说法正确的是
A.石墨属于过渡晶体
B.SiO2属于过渡晶体,但当作共价晶体来处理
C.绝大多数含有离子键的晶体都是典型的离子晶体
D.Na2O晶体中离子键的百分数为100%
【答案】B
【解析】A.石墨为混合晶体,只含一种物质,不属于过渡晶体,故A错误;B.SiO2属于过渡晶体,但性质上更偏向共价晶体,故当作共价晶体来处理,故B正确;C.大多数含有离子键的晶体不是典型的离子晶体,而是过渡晶体,故C错误;D.金属性越强,氧化物中离子键的百分数越大,电负性相差越大,离子键百分数越大,与电负性有关,Na2O晶体中离子键的百分数是62%,故D错误;故选:B。
►问题二 混合晶体结构及性质
【典例2】石墨晶体是层状结构(如图)。以下有关石墨晶体的说法正确的一组是
①石墨中的C为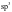 杂化;②石墨是混合晶体;③每个六元环完全占有的碳原子数是2个;④石墨熔点、沸点都比金刚石低;⑤石墨中碳原子数和C—C键之比为1:2;⑥石墨和金刚石的硬度相同;⑦石墨层内导电性和层间导电性不同;A.①②④ B.①②⑥ C.②③⑦ D.②④⑤
杂化;②石墨是混合晶体;③每个六元环完全占有的碳原子数是2个;④石墨熔点、沸点都比金刚石低;⑤石墨中碳原子数和C—C键之比为1:2;⑥石墨和金刚石的硬度相同;⑦石墨层内导电性和层间导电性不同;A.①②④ B.①②⑥ C.②③⑦ D.②④⑤
【答案】C
【解析】①石墨层内为平面结构,因此石墨中的C为sp2杂化,错误;②石墨中存在范德华力和共价键,还有金属键的特性,故石墨晶体兼有共价晶体、分子晶体、金属晶体的特征,属于混合晶体,正确;③每个六元环全占有的碳原子数是6×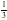 =2,正确;④石墨的熔点比金刚石的高,错误;⑤石墨中每个碳原子成3个共价键,因此石墨中碳原子数和C-C个数之比为2:3,错误;⑥石墨质软,金刚石的硬度大,错误;⑦石墨层内存在大π键,电子能自由移动,能够导电,而在层间只存在分子间作用力,因此层内和层间导电性不同,正确;故选:C。
=2,正确;④石墨的熔点比金刚石的高,错误;⑤石墨中每个碳原子成3个共价键,因此石墨中碳原子数和C-C个数之比为2:3,错误;⑥石墨质软,金刚石的硬度大,错误;⑦石墨层内存在大π键,电子能自由移动,能够导电,而在层间只存在分子间作用力,因此层内和层间导电性不同,正确;故选:C。
【解题必备】1.混合晶体的概念:晶体内同时存在若干种不同的作用力,具有若干种晶体的结构和性质。
2.石墨晶体的性质:
(1)熔点很高(层内碳原子之间全部为共价键,共价键能大);
(2)质软(具滑腻感)(原因:层与层之间依靠范德华力结合,范德华力小,层之间易于断开滑动);
(3)易导电(原因:石墨层中每个碳原子未杂化的平行P轨道上的电子形成离域大π键,其电子可在层内运动,成为自由电子)。
【变式2-1】氮化硼(BN)晶体有多种结构,六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,有白色石墨之称,具有电绝缘性,可作高温润滑剂。立方相氮化硼是超硬材料,硬度可媲美钻石,常被用作磨料和刀具材料。它们的晶体结构如图所示,关于两种晶体的说法,错误的是
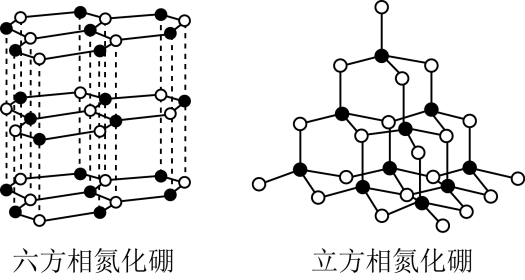
A.六方相氮化硼属于混合晶体,其层间是靠范德华力维系,所以质地软
B.立方相氮化硼含有σ键和π键,所以硬度大
C.六方氮化硼不能导电是因为其层结构中没有自由电子
D.相同质量的六方相氮化硼和立方相氮化硼所含共价键数不相同
【答案】B
【解析】A.六方相氮化硼与石墨晶体相同,属于混合晶体,其层间是靠范德华力维系,所以质地软,A正确;B.立方相氮化硼含有共价键和配位键,为σ键,所以硬度大,B错误;C.石墨层内导电是由于层内碳原子形成大 键,有自由移动的电子,而六方氮化硼不能导电是因为其层结构中没有自由电子,C正确;D.六方相氮化硼中每个原子合1.5条键,而立方相氮化硼中每个原子合2条键,则相同质量的六方相氮化硼和立方相氮化硼所含共价键数不相同,D正确;答案为B
键,有自由移动的电子,而六方氮化硼不能导电是因为其层结构中没有自由电子,C正确;D.六方相氮化硼中每个原子合1.5条键,而立方相氮化硼中每个原子合2条键,则相同质量的六方相氮化硼和立方相氮化硼所含共价键数不相同,D正确;答案为B
【变式2-2】下列有关石墨晶体的说法正确的是 ( )
A.由于石墨晶体导电,所以它是金属晶体
B.由于石墨的熔点很高,所以它是原子晶体
C.由于石墨质软,所以它是分子晶体
D.石墨晶体是一种混合晶体
【答案】D
【解析】石墨能导电、熔沸点高、质软,是因为其晶体结构中既有金属键,又有共价键,还有范德华力,因此它是一种混合晶体。答案选D。
►问题三 晶体熔、沸点高低的比较
【典例3】下列物质熔沸点高低的比较,正确的是
A.SiO2
【答案】C
【分析】不同类型晶体熔沸点高低的比较:一般来说,原子晶体>离子晶体>分子晶体;分子晶体中含有氢键的熔沸点较高;同种类型的分子晶体相对分子质量越大,熔沸点越高。
【解析】A、SiO2为原子晶体,CO2为分子晶体,熔沸点高低顺序为:SiO2>CO2,故A错误;B、CCl4与CF4都为分子晶体,相对分子质量越大,熔沸点越高,正确顺序应为:CCl4>CF4,故B错误;C、HF与HI都为分子晶体,HF能形成分子间氢键,则熔沸点较高,所以顺序为:HF>HI,故C正确;D、NaCl是离子晶体,HCl是分子晶体,则熔沸点顺序为:NaCl>HCl,故D错误;故选C。
【解题必备】晶体熔、沸点高低的比较
1.不同类型晶体熔、沸点的比较
(1)不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。
(2)金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。
2.同种类型晶体熔、沸点的比较
(1)共价晶体
原子半径越小→键长越短→键能越大→熔、沸点越高,如熔点:金刚石>碳化硅>硅。
(2)离子晶体
①一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其离子晶体的熔、沸点就越高,如熔点:MgO>NaCl>CsCl。
②衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔、沸点越高,硬度越大。
(3)分子晶体
①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体熔、沸点反常得高,如H2O>H2Te>H2Se>H2S。
②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。
③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高,如CO>N2、CH3OH>CH3CH3。
④同分异构体支链越多,熔、沸点越低。如CH3CH2CH2CH2CH3>CH3CH(CH3)CH2CH3>CH3C(CH3)2CH3。
(4)金属晶体
金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高,如熔、沸点:Na
【变式3-1】下列分子晶体中,关于熔、沸点高低的叙述正确的是
A.Cl2>I2
B.SiCl4<CCl4
C.NH3>PH3
D.C(CH3)4>CH3CH2CH2CH2CH3
【答案】C
【解析】A.氯气和碘分子结构相似,均属于分子晶体,相对分子质量越大,熔沸点越高,因此熔、沸点:Cl2<I2,故A错误;B.四氯化硅与四氯化碳分子结构相似,均属于分子晶体,相对分子质量越大,熔沸点越高,因此熔、沸点:SiCl4>CCl4,故B错误;C.氨气和磷化氢分子结构相似,均属于分子晶体,但是氨气分子间存在氢键,熔、沸点高,所以熔、沸点:NH3>PH3,故C正确;D.两种有机物分子式相同,但分子结构不同,属于同分异构体关系,分子中支链少的熔、沸点高,因此熔、沸点:C(CH3)4<CH3CH2CH2CH2CH3,故D错误;故选C。
【变式3-2】下列物质的熔、沸点高低顺序正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅 B.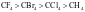
C.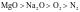 D.金刚石>生铁>纯铁>钠
D.金刚石>生铁>纯铁>钠
【答案】C
【解析】A.它们均是共价晶体,熔、沸点与键长成反向关系,因为键长: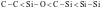 ,所以熔、沸点:金刚石>二氧化硅>碳化硅>晶体硅,A错误;B.组成和结构相似的分子晶体,相对分子质量越大,熔沸点越高,所以溶、沸点:
,所以熔、沸点:金刚石>二氧化硅>碳化硅>晶体硅,A错误;B.组成和结构相似的分子晶体,相对分子质量越大,熔沸点越高,所以溶、沸点: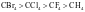 ,B错误;C.一般的离子晶体的溶、沸点大于分子晶体,氧化镁和氧化钠均是离子晶体,镁离子电荷数大于钠离子、半径小于钠离子,因此氧化镁中晶格能大于氧化钠,熔沸点:氧化镁大于氧化钠,氧气和氮气均是分子晶体,氧气相对分子质量较大,熔沸点较高,因此熔沸点的大小:
,B错误;C.一般的离子晶体的溶、沸点大于分子晶体,氧化镁和氧化钠均是离子晶体,镁离子电荷数大于钠离子、半径小于钠离子,因此氧化镁中晶格能大于氧化钠,熔沸点:氧化镁大于氧化钠,氧气和氮气均是分子晶体,氧气相对分子质量较大,熔沸点较高,因此熔沸点的大小: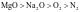 ,C正确;D.金刚石是共价晶体,熔沸点最高,合金熔沸点比成分金属低,因此纯铁熔沸点高于生铁,钠的熔沸点最低,所以熔沸点:金刚石>纯铁>生铁>钠,D错误;故选C。
,C正确;D.金刚石是共价晶体,熔沸点最高,合金熔沸点比成分金属低,因此纯铁熔沸点高于生铁,钠的熔沸点最低,所以熔沸点:金刚石>纯铁>生铁>钠,D错误;故选C。

![]()
1.下列说法不正确的是
A.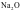 通常当作离子晶体来处理,因为
通常当作离子晶体来处理,因为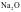 是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
B.由于石墨晶体导电,所以它是金属晶体,又由于它熔点很高,所以它是共价晶体,故石墨晶体属于混合晶体
C.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
D.石墨晶体中既有共价键,又有金属键还有范德华力,是一种混合晶体
【答案】B
【解析】A.一般电负性差值大于1.7为离子键,电负性差值小于1.7为共价键,Na2O通常当作离子晶体来处理,因为Na2O是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,A正确;B.石墨晶体中既有共价键,又有金属键和范德华力,所以是混合晶体但不属于金属晶体,B错误;C.根据微粒间的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型,C正确;D.石墨晶体中既有共价键,又有金属键和范德华力,是一种混合晶体,D正确;故选B。
2.下列说法正确的是
A.第三周期主族元素从左到右,最高价氧化物中离子键的百分数逐渐增大
B.大多数晶体都是过渡晶体
C.过渡晶体是指某些物质的晶体通过改变条件,转化为另一种晶体
D.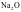 是纯粹的离子晶体,
是纯粹的离子晶体, 是纯粹的共价晶体
是纯粹的共价晶体
【答案】B
【解析】A.第三周期主族元素从左到右,元素的电负性逐渐增大,与氧元素的电负性差值逐渐减小,则最高价氧化物中离子键的百分数逐渐减小,A错误;B.纯粹的典型晶体不多,大多数晶体是四类典型晶体之间的过渡晶体,B正确;C.过渡晶体是介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,C错误;D. 、
、 都不是纯粹的典型晶体,而是离子晶体和共价晶体之间的过渡晶体,D错误;故选B。
都不是纯粹的典型晶体,而是离子晶体和共价晶体之间的过渡晶体,D错误;故选B。
3.下列叙述不正确的是
A.可以通过X射线衍射实验鉴别晶体与非晶体
B.混合晶体是混合物
C.等离子体是一种呈电中性的物质聚集体,其中含有带电粒子且能自由运动
D.纳米晶体具有不同于大块晶体特性的原因是晶体的表面积增大
【答案】B
【解析】A.构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X-射线衍射图谱反映出来,因此,可以通过X射线衍射实验鉴别晶体与非晶体,故A正确;B.石墨是混合晶体,石墨属于纯净物,故B错误;C.等离子体是一种呈电中性的物质聚集体,其中含有带电粒子且能自由运动,使等离子体具有导电性,故C正确;D.纳米晶体的特殊性质原因之一是它具有很大的比表面积,故D正确;选B。
4.要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小相关。由此判断下列说法正确的是
A.金属镁的硬度大于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
【答案】C
【解析】A、镁离子比铝离子的半径大而所带的电荷少,所以金属镁比金属铝的金属键弱,熔、沸点和硬度都小,A错误;B、从Li到Cs,离子的半径是逐渐增大的,所带电荷相同,金属键逐渐减弱,熔、沸点和硬度都逐渐减小,B错误;C、因离子的半径小而所带电荷多,使金属镁比金属钠的金属键强,所以金属镁比金属钠的熔、沸点和硬度都大,C正确;D、因离子的半径小而所带电荷相同,使金属镁比金属钙的金属键强,所以金属镁比金属钙的熔、沸点和硬度都大,D错误;答案选C。
5.下列各组物质的熔、沸点高低只与范德华力有关的是( )
A.Li、Na、K、Pb B.HF、HCl、HBr、HI
C.LiCl、NaCl、KCl、RbCl D.F2、Cl2、Br2、I2
【答案】D
【解析】A.Li、Na、K、Pb的熔沸点与金属键有关,故A错误;B.HF存在氢键,故B错误;C.LiCl、NaCl、KCl、RbCl的熔沸点与离子键有关,故C错误;D.都是分子晶体,熔化或者蒸发的时候只克服范德华力,所以熔沸点只与范德华力有关,故D正确;答案选D。
6.过渡晶体
(1)四类典型晶体是 、 、 、 。
(2)离子晶体和共价晶体的过渡标准是化学键中 。离子键成分的 ,作为离子晶体处理,离子键成分的 ,作为共价晶体处理。
(3)Na2O、MgO、Al2O3、SiO2、P2O5、SO3、Cl2O7七种氧化物中从左到右,离子键成分的百分数越来越小,其中作为离子晶体处理的是 ;作为共价晶体处理的是 ;作为分子晶体处理的是 。
【答案】(1)分子晶体 共价晶体 金属晶体 离子晶体
(2)离子键成分的百分数 百分数大 百分数小
(3)Na2O、MgO;Al2O3、SiO2;P2O5、SO3、Cl2O7
【解析】四类典型晶体是分子晶体、共价晶体、金属晶体、离子晶体;离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体处理,离子键成分的百分数小,作为共价晶体处理。
![]()
1.黑鳞的晶体结构是与石墨类似的层状结构,如图所示。下列有关说法不正确的是
A.黑磷晶体中片层间作用力为范德华力 B.黑磷与白磷均可导电
C.黑磷晶体的熔沸点比白磷高 D.1 mol黑磷晶体中含有1.5 mol P-P键
【答案】B
【解析】A.由黑鳞的晶体结构是与石墨类似的层状结构,为混合型晶体,片层间作用力为范德华力,A正确;B.白磷为分子晶体,黑磷结构与石墨类似为混合型晶体,则黑鳞能导电、白磷不导电,B错误;C.黑磷结构与石墨类似为混合型晶体,其熔沸点很高,故黑磷晶体的熔沸点比白磷高,C正确;D.可利用均摊法得黑磷晶体中1个磷原子形成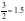 个共价键,则1
mol黑磷晶体中含有1.5
mol P-P,D正确;故选B。
个共价键,则1
mol黑磷晶体中含有1.5
mol P-P,D正确;故选B。
2.下列现象与氢键有关的是
①NH3的沸点比PH3的高;②乙醇能与水以任意比混溶,而甲醚(CH3-O-CH3)难溶于水;③邻羟基苯甲酸的熔沸点比对羟基苯甲酸的低;④水分子在高温下很稳定;⑤冰的密度比液态水的密度小;⑥NH3易液化;⑦NH3分子比PH3分子稳定;⑧在相同条件下,H2O的沸点比H2S的沸点高
A.①②③⑤⑥⑧ B.①②④⑤⑧ C.②③⑥⑧ D.①④⑥
【答案】A
【解析】①因ⅤA族中,N的非金属性最强,氨气分子之间存在氢键,则氨气的熔、沸点比ⅤA族其他元素氢化物的高,①正确;②因乙醇与水分子之间能形成氢键,则乙醇可以和水以任意比互溶,甲醚与水分子之间不能形成氢键,则甲醚((CH3-O-CH3)难溶于水,②正确;③对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,③正确;④水分子高温下很稳定,其稳定性与化学键有关,而与氢键无关,④错误;⑤冰中存在氢键,氢键有一定的方向性。水结冰后分子间的空隙变大,故其体积变大,则冰的密度比液态水的密度小,⑤正确;⑥NH3分子之间可以形成氢键,故易液化,⑥正确;⑦氮磷在同一主族,氮的非金属性大于磷所以NH3分子比PH3分子稳定,⑦错误;⑧H2O和H2S均为分子晶体,结构相似,但前者分子间存在氢键,所以在相同条件下,H2O的沸点比H2S的沸点高,⑧正确;所以①②③⑤⑥⑧正确;故选A。
3.下列关于物质特殊聚集状态结构的叙述中,错误的是
A.液晶具有液体的流动性,在某些物理性质方面具有类似晶体的各向异性
B.氧化镁晶体中离子键的百分数为50%,氧化镁晶体是一种过渡晶体
C.等离子体的基本构成粒子只有阴、阳离子
D.石墨晶体属于混合晶体
【答案】C
【解析】A.液晶像液体一样具有流动性,也具有晶体的各向异性,故A正确;B.氧化镁晶体中离子键、共价键的成分各占50%,所以氧化镁晶体是一种过渡晶体,故B正确;C.等离子体主要是由电子和正离子及中性粒子组成,故C错误;D.石墨晶体结构是层状的,每一层原子之间由共价键组成正六边形结构,层与层之间由范德华力互相吸引,石墨晶体属于混合晶体,故D正确;选C。
4.将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型的耐高温、耐磨材料,在工业上有广泛的应用。则氮化硅所属的晶体类型是
A.共价晶体 B.分子晶体 C.混合晶体 D.无法确定
【答案】A
【解析】根据在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,说明耐高温。氮化硅是一种新型的耐高温、耐磨材料,属于共价晶体的性质,是原子晶体,选A。
5.如图是石墨晶体的结构及晶胞示意图,有关说法错误的是
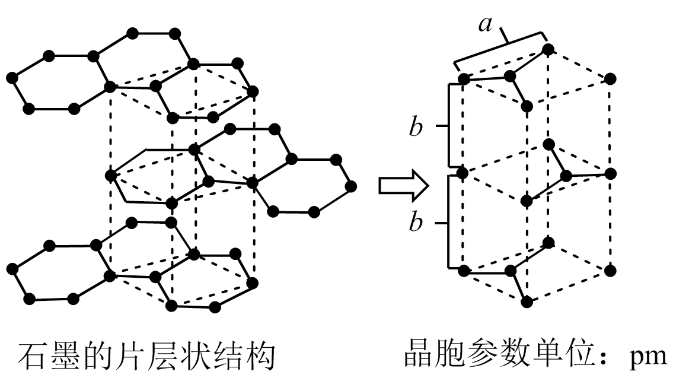
A.石墨中存在共价键、金属键以及范德华力,因此属于混合晶体
B.C-C-C的夹角:石墨<金刚石
C.石墨晶体沿片层与垂直片层方向的导电性不相同
D.石墨晶体的密度为(单位:g/pm3)ρ=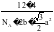
【答案】B
【解析】A.石墨中的碳原子用sp2杂化轨道与相邻的三个碳原子以σ键结合,形成正六角形的平面层状结构,而每个碳原子还有一个2p轨道,其中有一个2p电子.这些p轨道又都互相平行,并垂直于碳原子sp2杂化轨道构成的平面,形成了大π键,这些π电子可以在整个碳原子平面上活动,类似金属键的性质;石墨层之间存在分子间作用力,所以石墨中存在共价键、金属键和范德华力,属于混合晶体,故A正确;B.金刚石中碳原子与周围4个碳原子形成正四面体结构,碳原子采取sp3杂化,键角为109°28′,而石墨中碳原子与周围的碳原子形成3个C﹣C键,碳原子采取sp2杂化,键角为120°,故C﹣C键夹角大小为:石墨烯>金刚石,故B错误;C.石墨晶体中片层中存在金属键,导电性较强,垂直片层方向的作用力为分子间作用力,导电性较弱,所以石墨晶体沿片层与垂直片层方向的导电性不相同,故C正确;D.石墨晶胞中C原子个数=1+2×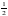 +4×
+4×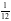 +4×
+4×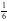 +2×
+2×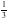 +2×
+2×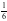 =4,晶胞体积=
=4,晶胞体积=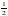 (apm)2×sin60°×2×(2bpm)=
(apm)2×sin60°×2×(2bpm)=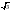 a2bpm3,石墨晶体密度=
a2bpm3,石墨晶体密度=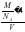 =
=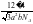 g/pm3,故D正确;故选:B。
g/pm3,故D正确;故选:B。
6.下列关于物质熔、沸点高低说法错误的是
A.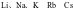 的熔、沸点依次降低
的熔、沸点依次降低
B.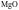 比
比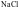 熔点高
熔点高
C.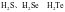 的熔、沸点依次升高
的熔、沸点依次升高
D.分子晶体中共价键的键能越大,分子晶体的熔、沸点越高
【答案】D
【解析】A.碱金属按Li、Na、K、Rb、Cs的顺序,半径依次增大,金属键依次减弱,熔沸点依次降低,故A正确;B.这两种物质都属于离子晶体,r(O2-)<r(Cl-)、r(Mg2+)<r(Na+),MgO阴阳离子所带电荷大于NaCl阴阳离子所带电荷,所以晶格能MgO>NaCl,则熔沸点:MgO>NaCl,故B正确;C.非金属性S>Se>Te,所以氢化物的稳定性:H2S>H2Se>H2Te;这几种物质都不能形成分子间氢键,分子间作用力:H2S<H2Se<H2Te,所以熔沸点:H2S<H2Se<H2Te,故C正确;D.分子晶体熔沸点与分子间作用力、氢键有关,与化学键的键能无关,故D错误;故选:D。
7.根据要求,回答下列问题:
(1)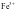 与
与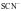 能生成血红色的
能生成血红色的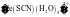 ,则中心离子的配位数是
,N、O、S的第一电离能由大到小的顺序为
;三氯化铁的熔点为
,则中心离子的配位数是
,N、O、S的第一电离能由大到小的顺序为
;三氯化铁的熔点为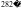 ,易溶于乙醚(
,易溶于乙醚(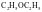 )等溶剂中,则其为
(填晶体类型)晶体。
)等溶剂中,则其为
(填晶体类型)晶体。
word文档下载地址:https://www.123huaxue.com/hx/2025/12726.html