
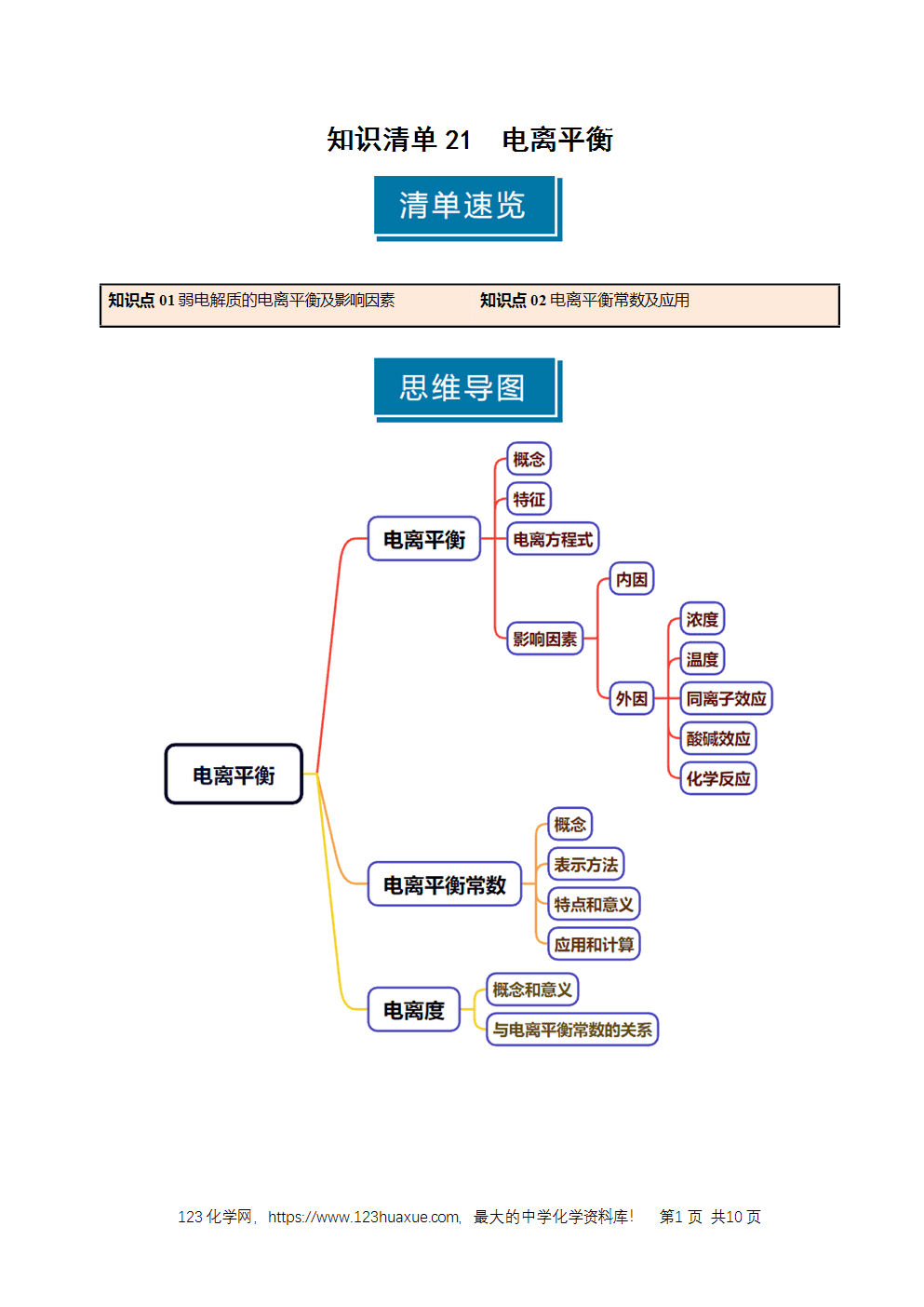








1.电离平衡
(1)电离平衡的建立
在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
平衡建立过程如图所示:
(2)电离平衡的特征
①弱:研究对象是弱电解质。
②等:弱电解质分子电离成离子的速率和离子重新结合成弱电解质分子的速率相等。
③动:电离平衡是一种动态平衡,即1mol CH3COOH电离同时则有1mol CH3COOH分子形成。
④定:条件不变,溶液中各分子、离子的浓度不变,溶液里既有离子又有分子。
⑤变:条件改变时,电离平衡发生移动,各粒子的浓度要发生改变。
2.影响电离平衡的因素
(1)影响电离平衡的内因:
影响电离平衡的内因是弱电解质本身的结构与性质,其他条件相同时,电解质越弱越难电离。
(2)影响电离平衡的外因:
①浓度:向弱电解质溶液中加水稀释,电离平衡向电离的方向移动,电离程度增大;
②温度:电解质的电离一般是吸热过程,升高温度,电离平衡向电离的方向移动,电离程度增大;
③同离子效应:加入与电解质电离出相同离子的强电解质,电离平衡向形成分子的方向移动,电离程度减小;
④酸碱效应:加入强酸(或强碱),弱酸(或弱碱)的电离平衡向形成分子的方向移动,电离程度减小;弱碱(或弱酸)的电离平衡向电离的方向移动,电离程度增大;
⑤加入能与离子反应的物质,电离平衡向电离的方向移动,电离程度增大。
以0.1 mol·L-1 CH3COOH溶液为例,填写外界条件对CH3COOH(aq)CH3COO-(aq)+H+(aq) ΔH>0的影响。