










第三节 氧化还原反应
第1课时 氧化还原反应
[核心素养发展目标] 1.能通过分析元素化合价的变化判断化学反应是不是氧化还原反应。2.知道氧化还原反应的本质是电子转移,能分析简单氧化还原反应中电子转移的方向和数目。3.理清氧化还原反应与四种基本反应类型之间的关系。
一、多角度认识氧化还原反应
1.从得失氧的角度认识氧化还原反应
思考1 请根据初中学过的氧化反应与还原反应的知识,分析以下反应,完成表格。
2CuO+C2Cu+CO2↑;
Fe2O3+3CO2Fe+3CO2。
结论:一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。也就是说,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
2.从元素化合价升降的角度认识氧化还原反应
思考2 (1)请标出思考1中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
提示
(2)在这两个反应中,得氧物质C和CO发生氧化反应时,相应元素化合价升高。
失氧物质CuO和Fe2O3发生还原反应时,相应元素化合价降低。
结论:凡是有元素化合价升降的反应都是氧化还原反应,物质所含元素化合价升高的反应称为氧化反应,物质所含元素化合价降低的反应称为还原反应。
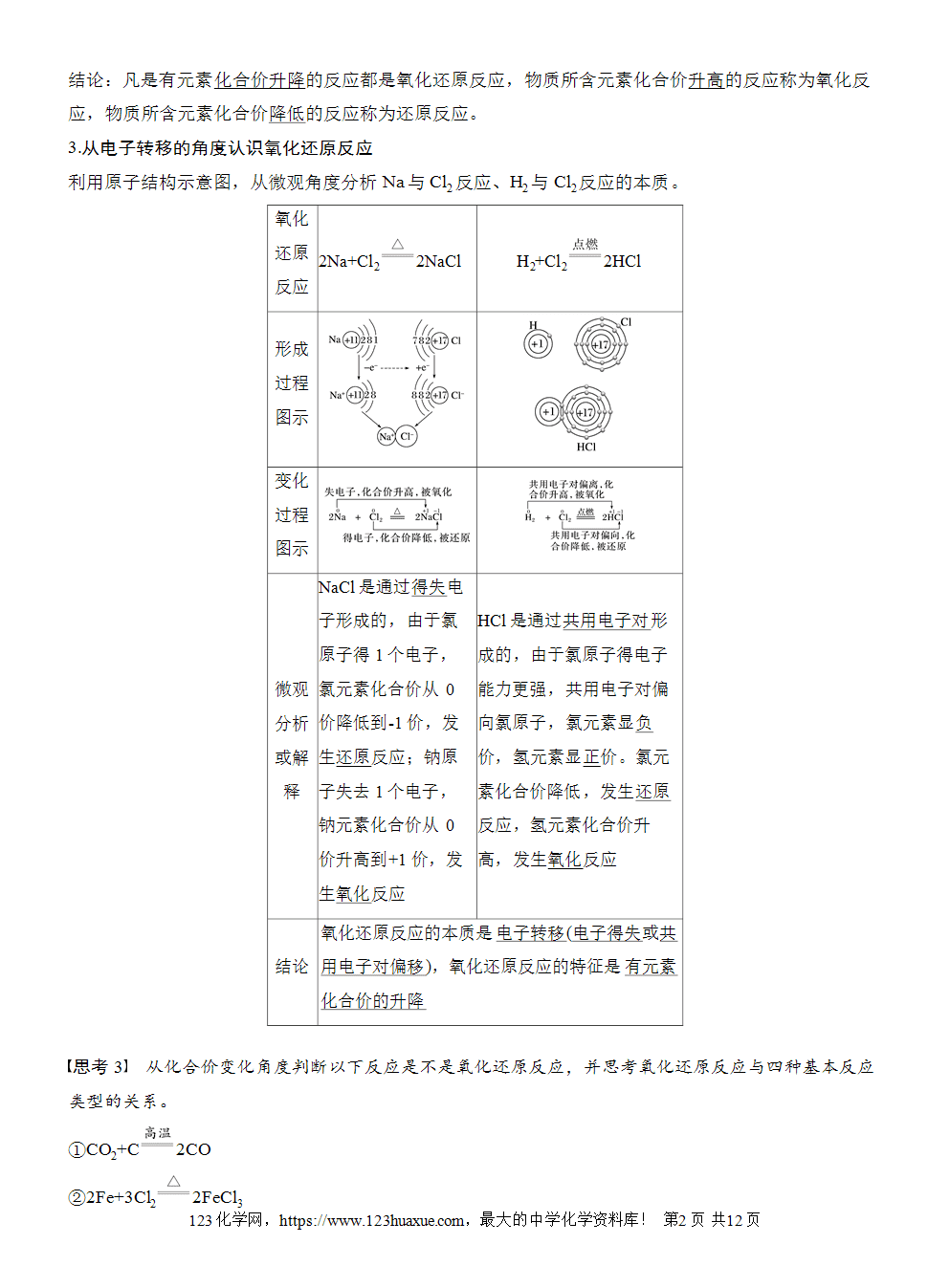
3.从电子转移的角度认识氧化还原反应
利用原子结构示意图,从微观角度分析Na与Cl2反应、H2与Cl2反应的本质。