
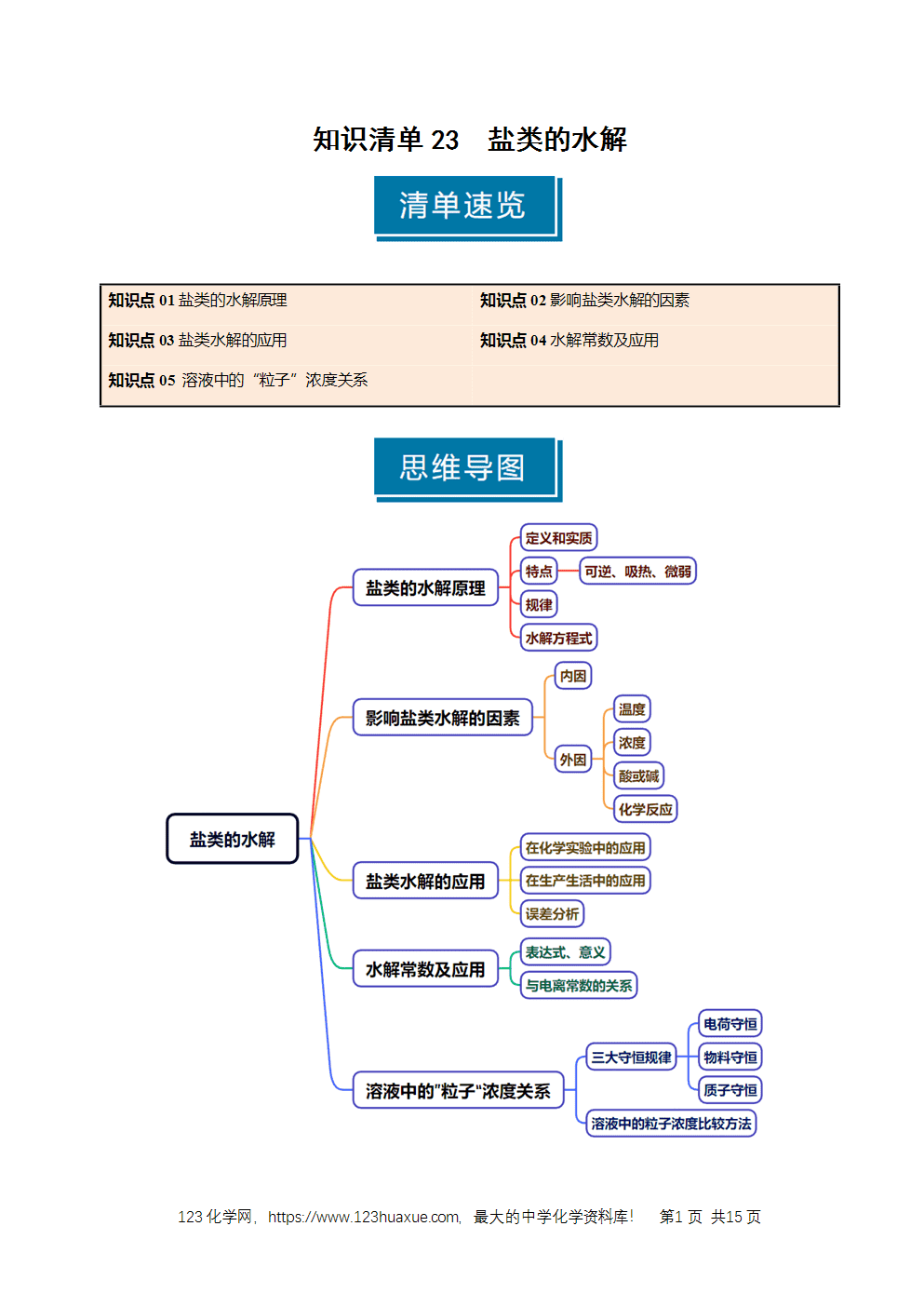













1.盐类的水解原理
(1)定义:在水溶液中盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质的反应。
(2)条件:可溶性盐中必须存在弱碱阳离子或弱酸根离子。
(3)实质:盐电离产生的弱碱阳离子或弱酸根离子结合水电离产生的OH-或H+生成弱电解质,破坏了水的电离平衡,水的电离程度增大。
2.盐类水解的特点
(1)可逆:盐类的水解是可逆反应。
(2)吸热:盐类的水解可看作是酸碱中和反应的逆反应。
(3)微弱:多数水解反应程度很微弱。
3.盐类水解的规律
有弱才水解,越弱越水解;谁强显谁性,同强显中性。