要用 VSEPR 理论解释三氧化硫(SO₃)分子的极性,需从分子构型、键的极性及电荷分布对称性三方面展开,具体分析如下:
一、VSEPR 理论推导 SO₃的分子构型
价层电子对计算硫(S)原子的价电子数为 6,每个氧(O)原子作为配位原子时,不提供电子(VSEPR 理论中,氧族元素作为配体时默认不贡献电子)。因此,硫原子的价层电子对数为: ,且无孤对电子(孤对电子数 = 0)。
,且无孤对电子(孤对电子数 = 0)。
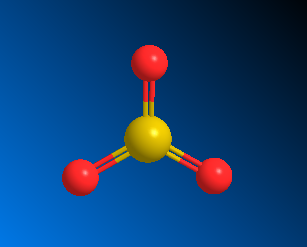
构型预测根据 VSEPR 理论,价层电子对数为 3 且无孤对电子时,分子构型为平面三角形,键角为 120°。硫原子位于中心,三个氧原子分布在三角形的三个顶点,形成对称结构。
二、键的极性与分子极性的关系
S-O 键的极性氧的电负性(3.44)高于硫(2.58),因此 S-O 键为极性共价键,电子对偏向氧原子,单个键存在偶极矩(方向由 S 指向 O)。
分子极性的判断分子的极性由整体电荷分布是否对称决定:
若分子构型对称,各键的偶极矩相互抵消,分子为非极性;
若构型不对称,偶极矩无法抵消,分子为极性。
三、VSEPR 构型对称性导致 SO₃分子非极性
在平面三角形构型中,三个 S-O 键的偶极矩大小相等、方向对称(键角均为 120°)。从矢量合成角度看,三个偶极矩相互抵消,整体分子的偶极矩为零,电荷分布均匀,因此 SO₃为非极性分子。
总结:VSEPR 理论的解释逻辑
VSEPR 确定构型:价层电子对互斥导致平面三角形,无孤对电子→构型对称。
键极性与构型结合:虽存在极性键,但对称结构使偶极矩矢量和为零→分子非极性。
类比参考:类似构型的 BF₃分子,因平面三角形对称结构,虽含极性 B-F 键,但整体为非极性分子。