1.杂化轨道的含义
杂化轨道理论是一种价键理论,是鲍林为了解释分子的空间结构提出的。
(1)轨道的杂化:在外界条件影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
(2)杂化轨道:原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。
(3)杂化轨道的特点
①杂化轨道数等于参与杂化的原子轨道数;
②杂化改变了原子轨道的形状和方向;
③杂化使原子的成键能力增强;
④杂化轨道用于构建分子的σ轨道和孤电子对轨道。
2.杂化轨道理论的要点
(1)原子形成分子时,通常存在激发、杂化和轨道重叠等过程。发生轨道杂化的原子一定是中心原子。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子不可能发生杂化。
(3)只有能量相近的原子轨道才能杂化(如2s、2p)。
(4)杂化前后原子轨道数目不变(参加杂化的轨道数目等于形成的杂化轨道数目),且杂化轨道的能量相同。
(5)为使相互间的排斥力最小,杂化轨道在空间取最大夹角分布。杂化后轨道的伸展方向、形状发生改变,但相同杂化形式的杂化轨道形状完全相同。杂化使原子的成键能力增加。形成的共价键更牢固。
(6)杂化轨道用于形成σ键或者用来容纳未参与成键的孤电子对。未参与杂化的p轨道可用于形成π键。分子的空间结构主要取决于原子轨道的杂化类型。
(7)杂化轨道成键时仍具有共价键的特征——方向性和饱和性
(8)杂化轨道数=中心原子上的孤电子对数+与中心原子结合的原子数。
3.杂化轨道类型
类型 | 形成过程 | 夹角 | 空间结构 |
sp3杂化轨道 | sp3杂化轨道是由1个s轨道和3个p轨道杂化形成的 | 109°28′ | 正四面体形 |
sp2杂化轨道 | sp2杂化轨道是由1个s轨道和2个p轨道杂化而成的 | 120° | 平面三角形 |
sp杂化轨道 | sp杂化轨道是由1个s轨道和1个p轨道杂化而成的 | 180° | 直线形 |
【特别说明】原子轨道发生sp杂化时,还有2个np轨道未发生杂化,若np轨道上有未成对电子,形成分子时2个np轨道上的电子会形成π键。
1)sp3杂化与CH4分子的空间构型
(1)杂化轨道的形成
碳原子2s轨道上的1个电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”,形成能量相等、成分相同的4个sp3杂化轨道。
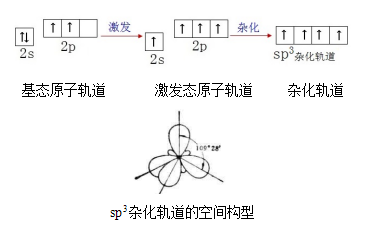
4个sp3杂化轨道在空间呈正四面体形,轨道之间的夹角为109°28',每个轨道上都有一个未成对电子。
(2)共价键的形成
碳原子的4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个相同的σ键。
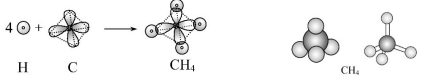
(3)CH4分子的空间构型
CH4分子为空间正四面体结构,分子中C—H键之间的夹角都是109°28′。
(4)正四面体结构的分子或离子的中心原子,一般采用sp3杂化轨道形成共价键,如CCl4、 NH4+等。金刚石中的碳原子、晶体硅和石英(SiO2)晶体中的硅原子也是采用sp3杂化轨道形成共价键的。
2)sp2杂化与BF3分子的空间构型
(1)sp2杂化轨道的形成
硼原子2s轨道上的1个电子进入2p轨道。1个2s轨道和2个2p轨道发生杂化,形成能量相等、成分相同的3个sp2杂化轨道。
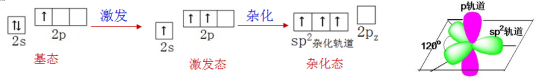
硼原子的3个sp2杂化轨道呈平面三角形,3个sp2杂化轨道间的夹角为120°。(2)共价键的形成
硼原子的3个sp2杂化轨道分别与3个氟原子的1个2p轨道重叠,形成3个相同的σ键。
(3)BF3分子的空间构型
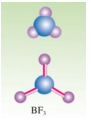
BF3分子的空间构型为平面三角形,键角为120°。
3)sp杂化与BeCl2分子的空间构型
(1)杂化轨道的形成
Be原子2s轨道上的1个电子进入2p轨道,1个2s轨道和1个2p轨道发生杂化,形成能量相等、成分相同的2个sp杂化轨道。
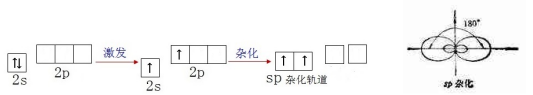
Be原子的sp杂化轨道呈直线形,其夹角为180°。
(2)共价键的形成
Be原子的2个sp杂化轨道分别与2个Cl原子的1个3p轨道重叠形成2个相同的σ键。
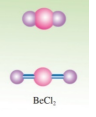
(3)BeCl2分子的空间构型
BeCl2分子为空间构型为直线形,分子中Be—Cl键之间的夹角为180°。