碳酸钠溶液的pH值随温度的变化是一个涉及水解平衡、离子积变化及溶解度影响的复杂过程。以下是其变化规律及机理分析:
一、温度对pH影响的机理
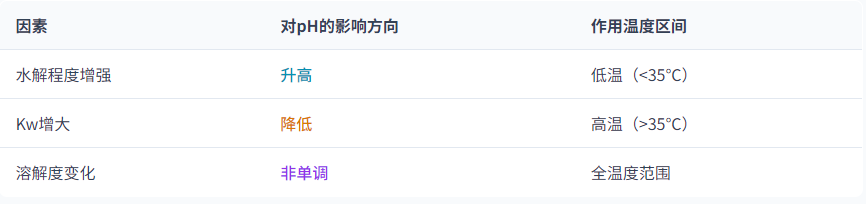
水解反应的吸热特性
碳酸钠溶液中存在多步水解反应:
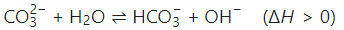
水解反应吸热,升高温度会促使平衡正向移动,生成更多OH⁻,溶液的碱性增强,pH值理论上应升高。
水的离子积(Kw)增大
水的电离也是吸热过程,温度升高导致Kw显著增大(如25℃时Kw=1×10⁻¹⁴,100℃时约为5.5×10⁻¹³)。此时H⁺浓度增加,可能部分抵消OH⁻浓度的升高 。
溶解度的影响
碳酸钠的溶解度在35.4℃时达到峰值(49.7 g/100g水),随后随温度升高略有下降。溶解度变化可能导致溶液中CO₃²⁻浓度的非单调变化,间接影响pH值 。
二、pH随温度变化的实际趋势
0~35℃范围内pH升高在较低温度区间(如0~35℃),水解反应主导,升温促进CO₃²⁻水解生成OH⁻,溶液的pH值逐渐升高。例如,20℃时0.1 mol/L Na₂CO₃溶液的pH约为12,30℃时升至约12.3。
高温阶段(>35℃)pH下降当温度超过35℃后,水的离子积(Kw)增大效应逐渐显著。尽管水解程度继续增加,但H⁺浓度的快速上升使溶液的pH值转而下降。例如,60℃时同一溶液的pH可能降至约11.5。
特殊条件下的矛盾现象实验中发现,加热0.1 mol/L Na₂CO₃溶液时,pH可能出现短暂下降。这可能是由于溶液中HCO₃⁻的进一步分解或CO₂的逸出导致局部酸性增加。
影响因素总结
四、实验验证与注意事项
实验方法使用pH计测量不同温度下的碳酸钠溶液,需注意以下条件:
溶液浓度:高浓度溶液水解更显著,pH变化更明显。
加热方式:缓慢均匀加热,避免局部过热导致CO₂逸出。
实例数据:以 0.1 mol/L Na₂CO₃溶液为例。
20℃时pH≈12.0
35℃时pH≈12.5
60℃时pH≈11.8
五、应用与意义
工业纯碱制备碳酸钠溶液的高温碱性被用于玻璃制造和去污剂生产,需根据温度调控pH值以优化反应效率。
缓冲溶液设计在生物化学实验中,碳酸钠-碳酸氢钠缓冲体系需考虑温度对pH的影响,避免实验偏差。
综上,碳酸钠溶液的pH值随温度升高呈现先上升后下降的非单调变化,这是水解平衡、离子积变化与溶解度共同作用的结果。实际应用中需结合具体温度范围调控溶液性质